顧問の西川伸一を中心に館員が、今進化研究がどのようにおこなわれているかを紹介していきます。進化研究とは何をすることなのか? 歴史的背景も含めお話しします。
バックナンバー
極地への適応II
2015年4月15日
前回は赤血球のない不思議な魚アイスフィッシュ(Icefish、コオリウオ)を紹介したところで終わった。脊椎動物の象徴とも言える赤血球を失った魚ということで、この特徴があまりにも強調されるが、極地に適応するためには他にも様々な変化が必要だ。前回紹介した体液を凍結から守るグリコプロテインのような新しい遺伝子の獲得も必要だが、生命の維持に必須の様々な分子を低温に適応した構造に変える必要がある。例えば神経の軸索や樹状突起の形成に必須の微小管は、チューブリン分子が重合してできるが、私たちの細胞ではこの重合は摂氏20度以下で阻害される。従って、摂氏0度を下回る温度で生きるためには、チューブリンの重合や分解が低温で維持できるよう分子構造を変える必要がある。実際、アイスフィッシュの脳から得られるチューブリンは、重合速度は遅いものの、摂氏0〜25度の範囲で重合が可能で、安定している。これを可能にする分子機構はすでに解明されており、アイスフィッシュにとどまらず、低温で生きる魚類に共通の遺伝子配列の変化が特定されている(J. Biol. Chem. 2000, 275:37038-37047)。同じ変異が、南極に住むアイスフィッシュにも、大西洋に住むタラにも見られることから、α,βチューブリンに低温でも微小管を形成できる能力を与える分子変化の可能性は限られており、地球上のどこでこの変化が起ころうと、この決まった門をくぐった種だけが適応できる(この結論の構造的基盤については、フリーアクセス論文に掲載されている図5、6参照)。もちろん同じような低温への適応はチューブリン分子にとどまらない。生体分子の機能は他の化学反応と同じで温度に影響されることから、機能が温度に敏感な分子のほとんどは極地に適応するための変化を起こす必要がある。例えばアイスフィッシュの筋繊維は通常の魚と比べると太くて長い。この構造変化は当然筋繊維を形成するアクチン、ミオシンを始めとする様々な分子に起こった変化の結果だし、また筋肉にエネルギーを提供するミトコンドリアにも相応の変化があるはずだ。また、LDH(乳酸脱水素酵素)のような基本的な酵素の活性を他の魚と比べると、アイスフィッシュではやはり摂氏0度近い温度でも酵素活性が維持されることがわかっている。実際に遺伝子配列を変化させる研究から、この差が1アミノ酸で起こることも確認されている。Hsp70は分子レベルで低温適応についての研究が進んだもう一つの分子だが、この分子はシャペロンと呼ばれ、たんぱく質の折りたたみの制御に関わっている。細胞が高温に晒されると、たんぱく質の沈殿を防ぐためこの分子が大量に作られるが、まず高温に晒されること自体のないアイスフィッシュにはこの高温によるHsp70発現の増加(熱ショック反応)はみられない。一方、低温もたんぱく質の折りたたみを障害する可能性があり、Hsp70自身のシャペロン機能は低温で働くよう至適化されている。このような研究からわかるのは、アイスフィッシュが低温に適応する過程の全体像を理解するためには、個々の分子機能の低温適応にとどまらず、系全体の変化を統合的に見ていくことの必要性だ。熱ショック反応喪失の例に見られるような分子の転写翻訳レベルでの適応、チューブリンやHsp70の例からわかるたんぱく質同士の相互作用の適応、そしてLDHの例に見られる酵素活性の低温への適応など、複雑に関連し合うそれぞれの分子レベルでの適応が必要だ。もちろん現在見られる全ての分子変異が同時に起こり得るはずはない。個々の分子に起こる偶然の変化を積み重ねるしかないが、現在の状態がどのように生まれてきたのかを想像することすら簡単ではない。例えば、一つの変異が個体の生存優位性につながったとしても、その結果他の分子との相互作用は当然制限される。このため、新たに生まれた変異を守るためには、それに合わせて他の分子を変化させる必要がある。この変異のカスケードがどの順番でどのように起こるのか?興味深いがアプローチの難しい課題だ。このことはとりもなおさず、自然選択を研究する上でアイスフィッシュは素晴らしいモデルとなっていることを意味している。残念ながらアイスフィッシュの全ゲノム解読はまだ終わっておらず、それぞれの分子に起こった適応の共通性や特殊性を研究するための遺伝子変化の全リストが得られるためにはもう少し時間がかかりそうだ。これまでの分子進化の研究はどうしても個々の遺伝子の変化に限定され、分子や細胞全体を総合的に見ることは、必要性は感じていても行われてこなかった。この意味で、16種類のアイスフィッシュ全ゲノムの解明は、進化を全ゲノムレベルで研究するためのきっかけになるのと期待できる。(アイスフィッシュの体全体で見られる適応についてはPhil. Trans. R. Soc. B (2007) 362, 2233–2258参照)。
ではこのような多くの構成成分を巻き込んだ変化にとって、ヘモグロビン遺伝子や赤血球分化に必要な遺伝子が失われることはどのような意味があるのだろう。前回、前々回紹介した匂いや味受容体は、失っても当面の生命維持には影響がない分子だ。従って、「生命や種の保存に必要のない遺伝子は自然に捨てられる」型の論理で片付けることができた。しかし、ヘモグロビンや赤血球は脊椎動物の生存に必須の分子だ。まずアイスフィッシュがヘモグロビンをどのように失っていったのか見てみよう。図1に基本的なヘモグロビン遺伝子の構造と、アイスフィッシュとその近縁のヘモグロビン遺伝子構造から考えられる遺伝子喪失過程を示している。
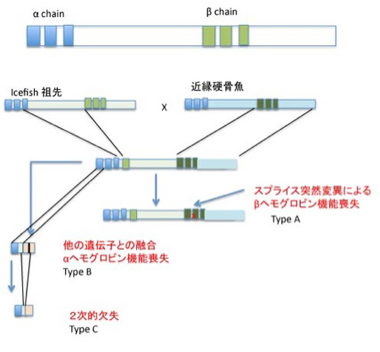
図1 ヘモグロビン遺伝子の構造と、アイスフィッシュの進化過程。硬骨魚ではαとβヘモグロビン遺伝子は並んで存在している。アイスフィッシュの進化過程でまず、2種類のヘモグロビン遺伝子座が融合しハイブリッド遺伝子座が生まれ、この祖先遺伝から、突然変異でβだけ欠損するtypeAと、領域の欠損によりα,β共に失われたtyhpeB, typeCの遺伝子が作られる。
図1からアイスフィッシュのヘモグロビン遺伝子座をtypeA, typeB, typeCの3種類に分けることができ、遺伝子機能喪失が多段階に起こっていることがわかる。しかも、他の遺伝子を元に描かれた分子系統樹とヘモグロビンの遺伝子型はあまり相関しておらず(図2)、ヘモグロビン遺伝子喪失過程のシナリオが描けても、遺伝子型の分布を説明することは簡単ではない。
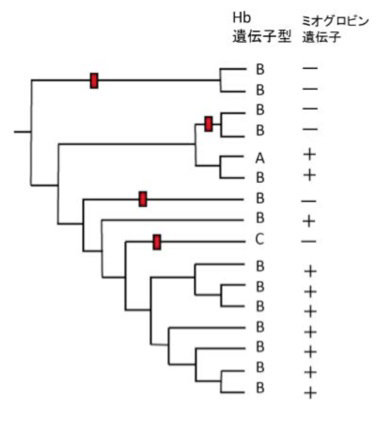
図2 アイスフィッシュ16種類の系統樹と、ヘモグロビン遺伝子型、ミオグロビン遺伝子発現。赤の印は、ミオグロビン遺伝子の消失時期を示している。
おそらくこの結果は、アイスフィッシュが数百万年という短い期間に大きな多様性を獲得していること、またその間に現在は絶滅して見られない多くの種が生まれ、現存の種の遺伝子構成に交雑等を通して寄与していると考えると説明がつく。この短期間での多様化と個体数の増大は、ヘモグロビンの喪失が進化にとって中立的な変化だと考えるより、極地での生存に有利な性質として考えたほうが良いことを示唆している。この可能性を示唆するのが、図2で赤く印をつけた、アイスフィッシュで現在進行中のミオグロビン遺伝子の喪失だ。この図に示したミオグロビン遺伝子の喪失は、それぞれ個別のイベントの結果起こったことが遺伝子の解析から分かっており、アイスフィッシュは今ミオグロビンを喪失する方向へ強く選択圧を受けているように見える。これを説明するためオブレイン(Kristin M. O'Brien)達は、ヘモグロビンやミオグロビンがNO(一酸化窒素)補足分子として働くため決して中立ではなく、その存在の有無は体内のNOの量に大きな影響を持ち、生存優位性に大きく影響すると提唱している。NOは1998年のノーベル生理学・医学賞の対象になったことからわかるように、体のホメオスタシスに重要な役割を演じており、特に血管を拡張させ、血管新生を促進して新血管機能を増強する。従って、ヘモグロビン、それに次いでミオグロビンが失われることで、血管網が増強され循環効率が増大すると期待できる。オブレイン達の総説(The Journal of Experimental Biology 209, 1791-1802, 2006:現在フリーアクセス)の図5にはヘモグロビンを持つ魚とヘモグロビン、ミオグロビン遺伝子を共に失ったアイスフィッシュの網膜血管を比べた印象的な写真が示されている。この写真から判断すると、血管の密度はおそらくヘモグロビン、ミオグロビンのないアイスフィッシュでは5倍以上になっているのではないだろうか。面白いことに、ミオグロビンだけを持たない魚はまだ見つかっていない点だ。すなわち、ヘモグロビンを失って初めてミオグロビンを失うという順序は変えられないようだ。このように、遺伝子喪失の効果は役に立たないから捨てていいと言った単純な話ではない。失うことは、様々な分子に影響を及ぼし、ポジティブ・ネガティブ取り混ぜた効果を持ちうる。読者の皆さんも、アイスフィッシュが不思議な魚にとどまらず、進化を理解するための重要なモデルになることが理解してもらえたのではないだろうか。いずれにせよ、アイスフィッシュ16種類の全ゲノム解析がますます待ちどうしい。おそらく今年には出てくるのではないだろうか。その時はぜひ緊急企画として報告したい。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)