RESEARCH
生まれてから変化する柔軟な脳
新生児は、大脳の視覚野が未熟なため、ぼんやりとしかものが見えません。生後、両目で色々なものを見ることで視覚野の神経回路が発達し、立体視できるようになり、7歳頃には大人並みの視力になります。幼児期に片方の目を眼帯で覆うと弱視になることから、この間に開いていた目に優位になるように視覚野の機能と形が再編成されると考えられています。
再編成できる時期(臨界期)はいつか、その時視覚野ではどんな変化が起きているのかを知るために、マウスを用いて実験しました。これまで可塑性が研究されてきたネコでは難しい分子・細胞レベルの研究をするためです。まず、マウスの片目をふさぎ、臨界期は生後22日から35日頃とわかりました。この時の視覚野の樹状突起に起こる変化に注目し、再編成の現場を捉えました。
1.脳は環境によって変化する
私たちの脳は、生後さまざまな環境に適応する柔軟性を持っている。幼児期の脳は、大人に比べて柔軟であり、特に感覚系や運動系に認められる柔軟さは、記憶や学習の基本になると考えられている。
身近で納得のいく例が、言語の習得である。幼児期に日本語と英語が母国語となる環境で育つと両方の言語を無理なく習得できる。ところが、大人になってからの外国語習得には時間や努力が必要で、私たち日本人は、 特に‘L’と‘R’の違いを聞き分けるのに苦労する。なぜだろう。
生後すぐの大脳は未熟ではあるが、過剰な神経回路を形成し、さまざまな環境に対応できる状態になる。その後、環境に応じて神経回路の再編成を行い、情報が整理整頓され、生涯必要な神経回路だけが固定されていくのである。これを「発達可塑性」という。この機能により、日本語のみの環境で育っていても、生後6ヶ月頃の赤ちゃんは‘L’と‘R’の区別がつくのに、1年後には日本語環境には必要ないと判断してしまうらしいのである。
2.視覚野での発達可塑性
「百聞は一見にしかず」ということわざの通り、私たちは視覚に頼って生きており、大脳の多くの領域は、視覚情報の処理のために使われている。ヒトの大脳視覚野は、左右の目からの情報を受けとり、ものを立体的に認識する能力をもつ。ここでも、誕生時の神経回路はかなり未熟であるため、新生児の間は、立体視ができず視力も低い。その後、視覚野の神経回路は急激に成熟し、やがて立体視できるようになり、視力も小学校に就学する頃に大人のレベルに到達する。
視覚野の神経回路が成熟する過程で大事なことは、幼児期に色々なものを見ることなのである。幼児期に正常な視覚体験ができないとどうなるのだろうか。 例えば、この時期に片方の目を眼帯で覆って生活すると、覆われた目は、正常な機能を保っていても弱視になってしまう。これは、左右の目から視覚野へ情報を送る神経細胞の軸索(註1)の支配領域や、情報を受けとる視覚野の神経細胞の特性(眼優位性:註2)が、開いていた目に優位になるように変化するためであり、この性質を「眼優位可塑性」という。ところが、たとえ同じ期間眼帯をしても、大人の視覚野ではこのような変化は起こらず、弱視にはならない。幼児期の視覚野は、大人よりも柔軟なのである。眼優位可塑性が最も顕著に表れる時期を「臨界期」という。この現象は、1981年にノーベル医学賞を受賞したヒューベル、ウィーゼル両博士により発見された。
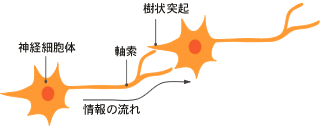
(註1) 軸索
神経細胞体からのびる突起のうち情報の送り手(樹状突起が受け手)としてはたらき、時には1mに達する。目からのびる視神経は、視床にて別の神経細胞と中継する。その神経細胞は、軸索をのばして視覚野へ投射する。
(註2) 視覚野の神経細胞の特性
視覚野の神経細胞は、眼優位性、方位選択性、方向選択性などの細胞特性を持ち、それぞれ生後発達期に成熟していくことが知られている。
3.臨界期の脳を知る
大脳視覚野の眼優位可塑性の研究は、ネコのように顔の正面(前額断)に目が2つあり、左右の目からの情報を受けとる両眼性の神経細胞が視覚野に存在すると期待できる動物で行われてきた。実際に、臨界期のネコの片目(例えば左目)をある期間ふさいだ後に目をあけて、棒状の光を目の前で動かしてみると、どちらの目にも応答していた両眼性の神経細胞が、左目に対してはほとんど応答せず、右目に対してより多く応答することがわかっている(機能の可塑性)。また、左目をふさぐ前後で、目からの情報を視覚野へ送る神経細胞の軸索(以下神経軸索)の支配領域を観察すると、左目に由来する神経軸索は退縮し、右目からのは拡大していることも分かっている(形の可塑性)。ただ、ネコでは分子や細胞レベルの研究が難しい。
そこに、画期的な報告が出された。目が正面ではなくやや横についているため、立体視ができず、機能の可塑性の評価は難しいと考えられていたマウスで、実はそれができるという報告である。1996年、UCSF(アメリカ州立カリフォルニア大学サンフランシスコ校)のストライカー博士のグループが、マウスの視覚野に、ほぼ個体差なく両眼性の神経細胞が集まる領域が存在することを実証し(図1)、片目をふさぐことで、ネコと同じように神経細胞の応答性が変化する臨界期(生後4週目)を決定できたのである(図2左)。さらに1999年には、神経軸索の形態変化も確認できた(図2右)。ここから眼優位可塑性研究は急速に展開する。
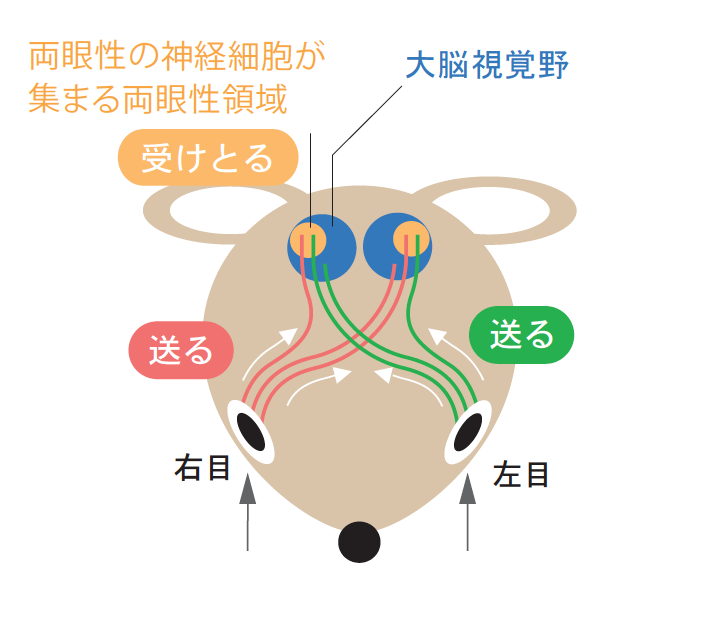
(図1) マウスの中枢視覚経路
両目からの視覚情報の一部は、大脳の視覚野の両眼性領域(視覚野の1/3程度)へ運ばれる。
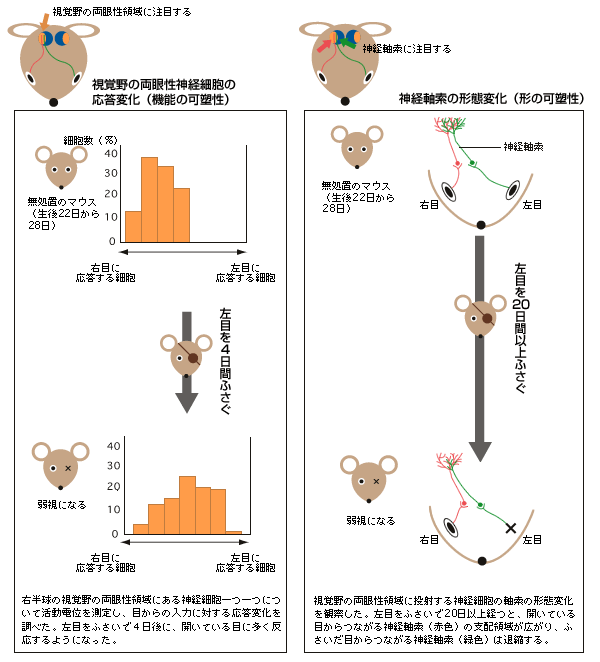
(図2) 視覚野の両眼性領域での機能の可塑性と形の可塑性
マウスなら、分子・細胞を用いた実験ができると考えた私たちは、眼優位可塑性に関与する候補遺伝子を改変したマウスを用いて、臨界期がどうやってはじまるかを調べるという計画を立てた。視覚野の神経細胞のうち約8割は、目からの情報を受けとると次の細胞へと情報を伝える興奮性の神経細胞(錐体細胞など)だが、その興奮を抑える抑制性の神経細胞も存在し、この両者のバランスで局所回路(ネットワーク)が成り立っている。私たちは、両目で色々なものを見ることで特定の抑制性の情報伝達(註3)が成熟し、視覚野の興奮と抑制のバランスが最適化すると臨界期が始まることを発見した。臨界期の開始のしくみを、マウスを用いることで分子レベルで明らかにできた初めての成果である。
(註3) 抑制性の情報伝達
抑制性の神経伝達物質としては、GABA (ギャバ) が上げられる。抑制性の神経細胞から遊離されるGABAを合成する酵素のひとつをはたらかなくしたノックアウト(KO)マウスでは、興奮と抑制のバランスが最適化されず、臨界期が始まらない。このKOマウスや臨界期が始まる前の野生型マウスでは、GABAを受けとる受容体のはたらきを高めてやると、機能の可塑性が高まることから、GABAが臨界期の開始に関与していると考えられている。
4.神経回路の再編成の初期過程を捉える
マウスでの研究が可能になったので、臨界期に起きる現象の詳細な解析に取り組んだ。臨界期が始まった後にマウスの片目をふさぐと、視覚野の機能と形が変化し、その変化が神経回路の再編成につながる。形については、これまでの研究で神経軸索の形態変化が確認されているが(図2右)、その変化には20日間以上の期間を要する。一方の機能、つまり神経細胞の応答変化は3~4日間程度しかかからないのである(図2左)。
私たちは、この2つの現象にかなりの時間的な差があることを疑問に思い、微細な形態変化を探ることにした。そこで、「神経細胞間の情報伝達の場であるシナプス(註4)で、神経細胞の応答性が変化するのと同時期に、形態変化が起こっているのではないか」という仮説をたてて実験を始めた。
神経細胞の可視化技術には、長い伝統がある。ゴルジ博士(註5)は、約100年前に、任意の神経細胞の可視化に成功している。現在では、先人が築き上げた技術に加えて、脂溶性の蛍光色素を脳組織切片の細胞に取り込ませ、神経細胞の隅から隅までを3次元像として可視化できる(図3A)。
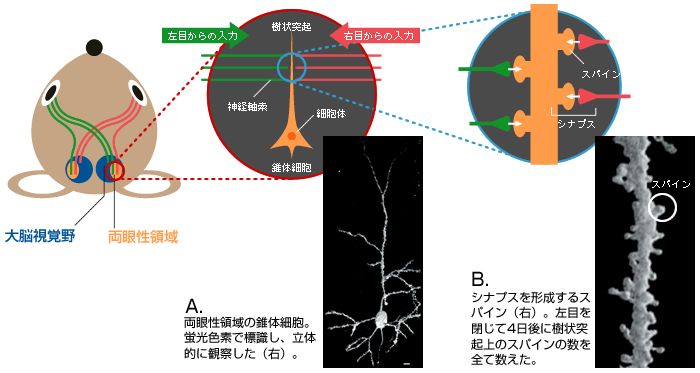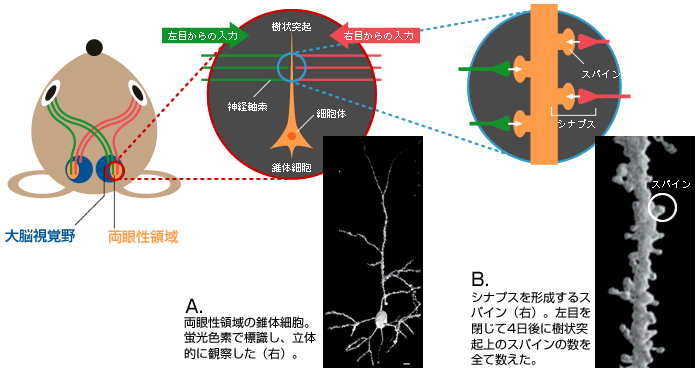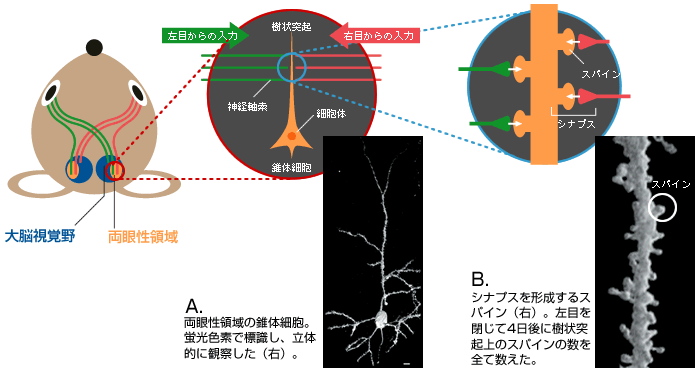
(図3) 情報伝達の場である「シナプス」
両眼性領域に存在する錐体細胞(A)の樹状突起上のスパイン(B)。左右の目から興奮性の情報を伝える神経軸索と多数のシナプスを形成している。
この技術を工夫して、両目からの情報を受けとる興奮性の錐体細胞の樹状突起上にあるスパイン(シナプス後部)の数を細胞体から樹状突起の先端まで数えたのである(図3B)。すると、臨界期に限って左目を4日間ふさいだマウスでのスパインの数が減少していた(図4)。左目からの入力が失われたため、スパインが「剪定」されたのではないかと考えている。新旧の科学技術を巧みに用いることで、細胞の微細構造まで観察し、神経回路の再編成の初期過程を捉えることができた。そして、この現象が機能の変化と同じような時期に始まっていることが実証されたのである。
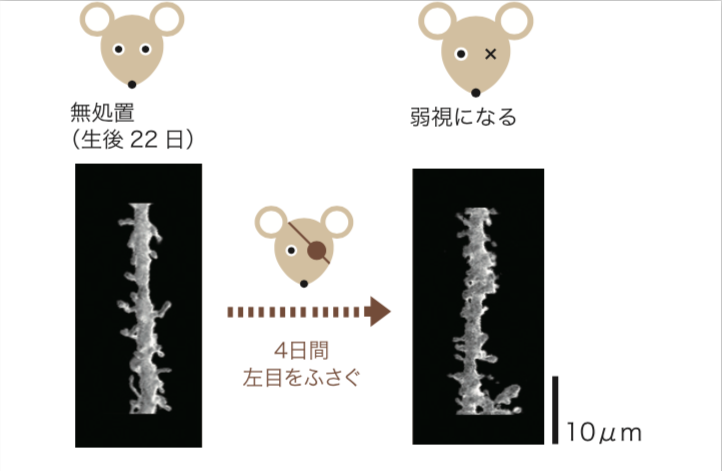
(図4) スパインの「剪定」
臨界期に左目を4日間ふさいだマウスの視覚野の錐体細胞を観察すると、樹状突起上のスパインが減少していることから、スパインが「剪定」されたと考えられる。
Neuron 44, 1031-1041(2004)より改変
(註4) シナプス
神経細胞相互の結合部位であり、情報伝達の場。前部(主に神経軸索)と後部(主に樹状突起部)とが細胞接着因子などによってつなぎとめられている。
(註5) ゴルジ博士
イタリアの神経学者カミーロ・ゴルジ (1844-1926)。
銀を使った染色方法で神経細胞の可視化に成功し、神経細胞内で入り組んだ器官を発見した。その細胞小器官は、彼の名にちなんで、「ゴルジ体」と名付けられている。
5.形態変化に必要な分子をみつける
ここで、臨界期では、なぜスパインの剪定が起きるのだろうという問いが生まれるが、それを考える前に形態変化そのものについて考えておく必要がある。通常、視覚野の神経細胞の周りは細胞接着分子や細胞外の基質タンパク質によって安定に保たれている。私たちはマウスを用いる前、ネコで研究していた頃から、「神経細胞の形態が変化するには、神経細胞外の環境が流動的になる必要があるのではないか」という仮説を持っていた。
そこで、1993年にカンデル博士(註6)のグループが「海馬の興奮性を高めた時にはたらく遺伝子のひとつに組織型プラスミノーゲンアクチベーター(tPA、(註7))がある」という報告を出した時、私たちは、tPAが視覚野の神経回路の再編成にも関与するかもしれないと考え、tPAの阻害剤を仔ネコに投与したのである。その結果、目をふさいだ前後の視覚野の神経細胞の応答変化、つまり機能の可塑性が、阻害剤を加えない仔ネコに比べて低下することが分かった。マウスでの研究ができるようになってから、tPA遺伝子をはたらかなくしたノックアウト(KO)マウスを用いて調べたところ、生涯にわたり、視覚野の神経細胞の眼優位性の変化は確認されなかった。逆にこのマウスにtPAを投与し続けると成熟したあとでも可塑性が起きる。つまり、tPAは機能の可塑性の維持に必須な因子であり、tPAがないと臨界期が現われないのである。
臨界期の野生型マウスの片目をふさぎ、視覚野内のtPAの分解酵素としての活性を測定すると、2-4日後にその活性が最も高く、臨界期が終わる頃に元のレベルに戻ることがわかった。成熟マウスで片目をふさいでも、tPAの酵素活性は上がらない。tPAの酵素活性の動態が、機能の可塑性と見事に一致するのである。
脳内では、特有の分子がはたらいていると考えがちだが、tPAは、血液線溶系(註8)ではたらくごくありふれたタンパク質分解酵素である。その酵素tPAこそが、神経細胞外の環境を流動的にする鍵となる候補となったのである。
(註6) エリック・カンデル
2000年にノーベル生理学・医学賞受賞した神経学者。
(註7) 組織型プラスミノーゲンアクチベーター(tPA)
血液凝固・線溶系において、プラスミノーゲンを分解して、活性プラスミンにする酵素。脳内での研究は数少ないが、1980年から小脳の顆粒細胞の移動や神経突起の伸長、海馬の長期増強、脳虚血時の細胞死などに関与するとの報告がある。最近、神経栄養因子(BDNF)の成熟やNMDA型グルタミン酸受容体の活性化などに関与する可能性も発表され、脳内でも興味深い分子になってきた。
(註8) 血液線溶系
血栓を溶かす一連の作用系。
6.tPAとスパイン剪定の関わり
ここで、tPAはスパインの剪定と関わっているだろうかと問うことができる。tPA KOマウスでは、野生型で臨界期にあたる頃に片目をふさいでも、スパインの数は減少しないが、tPAを投与すると、スパインの剪定が起きる。スパインの剪定にtPAの酵素活性が必須であると考えられる。更に、興奮と抑制のバランスが崩れているために臨界期が始まらないKOマウスの片目をふさいだら、tPA酵素活性の上昇やスパインの剪定は起こらず、このマウスに機能の可塑性を高める処置をすると(註3)、スパインが剪定されることもわかった。
これらの結果から、スパインの剪定は、「臨界期」で神経回路が再編成される初期に見られる現象であると言ってよい。tPAは、興奮と抑制の最適なバランスを捉えて細胞外の環境を柔軟にし、スパインを剪定しやすくするのではないかと考えている(図5)。現在は、tPAとプラスミン(註9)が本当に酵素としてはたらいているかどうかを調べている。スパインの成熟に関与する細胞接着分子を、プラスミンが限定分解することがわかってきた。
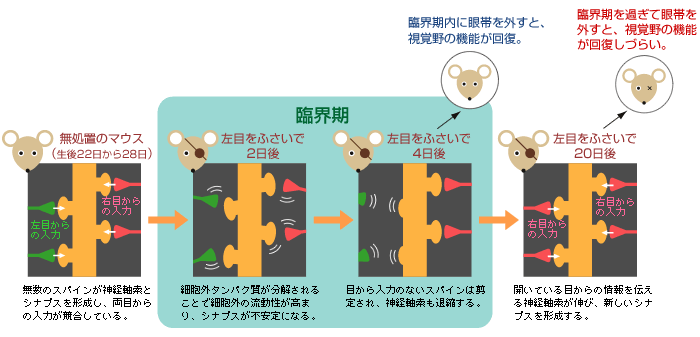
(図5) スパインが剪定される様子(モデル図)
細胞外環境が柔軟になることで、シナプスが不安定になる。そこで、目からの入力がない状態が続くと、神経軸索や退縮し、神経回路の再編成される。
心筋梗塞の治療薬であるtPAが、脳内に入って神経細胞死を起こしたという症例が報告されて以来、脳内におけるtPAの役割は「悪役」とされてきた。しかし、これは脳内で重要な役割をしているのである。とはいえ、「tPAを大量に投与して頭を柔らかくしよう」などという単純な話にはならない。tPAは、適切な時期に適切な量はたらくことが大切なのである。
これからも、tPAを手がかりとして、可塑性の分子メカニズム解明を続け、脳機能の発達を知りたいと思っている。それが、脳機能に異常が認められる精神・神経疾患の治療薬開発につながれば幸いである。
(註9) プラスミン
tPAやウロキナーゼによって限定分解されて生じる一種のセリンプロテアーゼ。
俣賀宣子(またが のぶこ)
東邦大学理学部化学科卒業。薬学博士。(財)大阪バイオサイエンス研究所、東京医科歯科大学難治疾患研究所助手を経て、1997年より理化学研究所脳科学総合研究センター神経回路発達研究チーム(ヘンシュ貴雄チームリーダー)専門職研究員。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)
.jpg)
.jpg)