年度別活動報告
年度別活動報告書:2002年度
アゲハチョウの食草選択と進化
吉川 寛(常勤顧問)
小野 肇(奨励研究員)
尾崎克久(奨励研究員)
尾崎展子(研究補助員)
広崎由利恵(研究補助員)
はじめに
昆虫は寄主選択、配偶行動、集団生活の維持など様々な場面において化学物質を巧みに利用している。昆虫と環境との関わり、その結果として生じる多様化、種分化、進化の謎を解くために、嗅覚や味覚といった化学受容に関わる分子の解明が有力な手がかりになると考えられる。
アゲハチョウは単食性に近い食草選択をしており、食草選択とアゲハチョウ科の進化とに相関関係が認められる。このことに注目して、雌成虫は前脚ふ節に存在する感覚毛によって食草に含まれる化合物を識別して産卵することが明らかにされた。最も良く研究されているナミアゲハ(Papilio xuthus)では、ウンシュウミカンの葉から産卵刺激物質として10種類の化合物が単離されている1)。それらは、主としてフラボノイド、アミン類、糖の誘導体に分類される。ほかにも数種のアゲハ類で産卵刺激物質が明らかにされており、アゲハチョウの系統と産卵刺激物質の構造を比較すると、アゲハ類は特定の系統の化合物群を寄主認識の手がかりとしながら食性の幅を広げたと考えられる。感覚毛には典型的な味覚細胞が存在することから、味覚細胞には産卵刺激物質特異的な味覚レセプターが発現していることが予測される。アゲハチョウにおいて、味覚のレセプターは種ごとに特徴的な多様なレパートリーを持っていることが予想され、それらを網羅的に解析すれば、レセプター進化と食性の変化の関係を解き、種分化の謎に迫れると考えた。
昆虫の味覚レセプターの研究は2000年になって初めてショウジョウバエから候補遺伝子として新規の7回膜貫通Gタンパク質共役型レセプター(以下GPCRと略)ファミリーが同定された2)。以降、ハマダラカとオオタバコガについて化学感覚器官に特異的に発現するGPCRが発見されている3) 4)。これらのレセプターはその構造の多様さのため、いずれも全ゲノム配列情報から明らかにされている。また、嗅覚、味覚などの化学物質がリンパ液中の細胞表面に存在するレセプターに到達するために、これら化合物を結合し運搬する蛋白(Odorant Binding Protein=OBP)がしられている。これについても最近ショウジョウバエ全ゲノムの解析から昆虫には多種類のOBP遺伝子が存在し、味覚器官に特異的に発現するものも明らかになった5)。このように昆虫の味覚レセプターとOBPに関する配列情報が蓄積されつつあることは、情報科学的手法を用いてアゲハチョウの産卵刺激物質選択にかかわる遺伝子群をクローニングする道が開けた。一方昆虫には神経伝達に作用するアミン類のレセプターが知られている。面白いことにこれらのアミン類と同種、あるいは類縁体がアゲハの産卵刺激物質として作用している。味覚物質としてのアミン受容体と神経物質としての受容体は同種かどうかも興味深い課題である6)。
そこで、産卵刺激物質の全容が明らかにされているナミアゲハを材料に前脚ふ節に発現する味覚レセプター遺伝子、OBP及びアミン受容体のクローニングを目的とした。前年度cDNAライブラリーの調製、大量配列方法の確立、RT-PCRによる発現部位決定法を確立したので、本年度はcDNAクローンの網羅的な配列決定と、得られた配列の情報解析、発現解析を行った。その結果、味覚レセプター候補として雌ふ節に特異的に発現する7回膜貫通型GPCRを発見した。また、クローニングした12種類のOBPの内2種類はふ節特異的に発現することが分かった。アミン類については、ふ節に発現する3種のアミンレセプターをクローニングし構造、発現およびゲノムコピー数を解析した。一方、cDNAライブラリーからの解析は限界に達したと考え、既に得られた候補遺伝子を出発材料として、ゲノム上の遺伝子群を網羅的に分離することを目的に、ナミアゲハゲノムライブラリーを作製した。
結果と考察
1. 塩基配列の決定と相同性検索
約6200クローンについて両方向から塩基配列配列を決定し、配列の類似性をもとにクラスター解析を行った。塩基配列の90%以上が一致しているものを同一のクローンとした結果、EST数は約2500種類となった。全EST中1817個(72%)が独立クローンであったことは、高品質なcDNAライブラリーを作成できたものと考えられる。また、重複数が発現量の多い遺伝子に大きく偏っている点が特徴的である(図3)。
全てのESTについて、塩基配列を自動的にアミノ酸配列に変換してアミノ酸配列データベースを検索するBlastXを用いてホモロジー検索を行った。データベースにホモロジーの高い遺伝子が見つかった場合を「Found」、ホモロジーの高い遺伝子を特定できなかった場合を「Not found」、60個以上連続するアミノ酸配列を得られなかった場合を「UTR」とし、3つのカテゴリーに分類した結果、Foundが38%、Not foundが50%、UTRが12%であった(図4)。ESTの配列長が400bpに満たないサンプルを削除して同じ解析を行った結果、これらの比率に変化は見られなかった。このことから、ESTの配列長とは無関係に全体の約10%程度非コード領域のみのデータが含まれていると考えられる。
 |
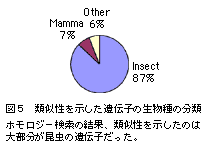
| 類似遺伝子が見つかったESTについて生物種の分類を行った結果、昆虫の遺伝子と類似性を示したものが87%、ほ乳類の遺伝子と類似性を示したものが7%、その他の生物の遺伝子と類似性を示したものが6%であった(図5)。昆虫の遺伝子と類似性を示したESTを分類すると、アゲハと同じ鱗翅目昆虫のものが29%、研究例の多い双翅目昆虫のものが69%で、合わせて98%となった。 |
 |
2. GPCRの検出とクローニング
アミノ酸配列からタンパク質の立体構造を推定し、膜貫通領域の周期性を重視してGPCRの候補遺伝子を検出するアルゴリズムである、Quasi-periodic Feature Classifier ( QFC)を用いてGPCRの検索を試みた。ホモロジー検索の結果、Not foundに分類されていたESTの中から、重要と思われるGPCR候補が2つ見つかった。これらについて、プライマーを設計しインサートの全長配列を決定した。
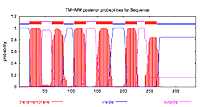
EST番号PXFT-01604は、インサートサイズが1660bpあり、アミノ酸配列は338残基であった。SOSUI及びTMHMMを用いて膜貫通領域を推定した結果、どちらのアルゴリズムでも周期的な膜貫通領域が検出された(図6)。Pfamデータベースを用いて保存ドメイン情報を検索した結果、7tm_1 (ロドプシン・ファミリーGPCR)と高い相同性を示した。この結果から、PXFT-01604はロドプシンファミリーのGPCRであると考えられる。RT-PCRで発現部位を推定した結果、ふ節以外の組織でも発現していることが明らかになった。N-単領域を含む完全長cDNAは得られていない。
|
SOSUI http://sosui.proteome.bio.tuat.ac.jp/sosuiframe0.html
 |
| TMHMM http://www.cbs.dtu.dk/services/TMHMM/ |
図6 PXFT-01604の膜貫通領域の推定
どちらのアルゴリズムを使っても、周期的な膜貫通領域が検出された。
EST番号PXFT-01989は、インサートサイズが2911bpであった。アミノ酸配列に変換すると、終止コドンによってORFが3つに分断されていた。cDNAライブラリー作成時に何らかのエラーが入った可能性が考えられる。決定した全長配列を用いてBlastXによるホモロジー検索を行った結果、ORF3の部分がオオタバコガの化学レセプター配列に類似性を示した。ORF3の配列を用い、配列の類似性よりもドメインとしての保存性を重視して検索を行うPSI-Blastを用いて検索を行った結果、オオタバコガの化学レセプターの他に、ショウジョウバエの味覚レセプターがヒットし、E-valueが信頼度の高い値を示した。PSI-Blastによってドメインとしての保存性が示唆された領域をアライメントした結果、膜貫通領域5番・6番・7番がほぼ一致していた。この結果から、PXFT-01989 ORF3 は化学受容に関与するGPCRとしての保存性ドメインであると考えられる。RT-PCRで発現部位を推定した結果、感覚毛のある雌ふ節に特異的な発現を示した(図7)。この結果から、PXFT-01989は味覚受容に関与しているGPCRとして重要な候補であると考えられる。
 |
図7 PXFT-01989のRT-PCR
雌ふ節に特異的な発現パターンを示す。OBP3は、同じcDNAテンプレートを用いて別のプライマーでPCRを行った結果。
3. 嗅覚物質結合蛋白の検出とクローニング
BlastXによるホモロジー検索の結果、odorant binding protein(OBP)の候補が12個検出された。OBPは4個cysteine が保存されているOS-Dと6個cysteine が保存されているGOBP/PhBPの二つのグループに別れた。RT-PCRの結果、アゲハOS-Dに含まれる PX-OBP1・PX-OBP7、GOBP/PhBPに含まれるPX-OBP8が感覚器官であるふ節または触覚で特異的に発現していることが明らかになった(図8)。この結果は一部のOBPが味覚受容に関与している可能性を示唆している。
 |
図8 OBP候補の発現パターンの模式図
感覚毛のある組織に特異的発現を示すOBPが存在する。発現部位の番号は図7参照。
アミンレセプターのクローニングおよび解析
神経伝達物質およびその類縁体であるアミン類がアゲハ類の産卵刺激物質として同定されている。一方で、これまでに数種の昆虫から神経伝達物質のレセプターがGPCRとしてクローニングされている。これより、産卵刺激物質のレセプターの中でも、アミン類に対するレセプターは神経伝達に働くレセプターと共通性を持っているかも知れない。
このような可能性を検討する目的で、昨年度より、アゲハにおいて発現する神経伝達物質(アミン)レセプターのクローニングおよび解析を行った。
昨年度、アゲハ頭部に発現するセロトニンおよびオクトパミンのレセプターのクローニングについて報告した。本年度は、これらのレセプターがふ節でも発現していることを確認した。さらに、フェニルエチルアミンレセプターの保存領域からdegenerate primerを設計してPCRによりアゲハふ節から調製したcDNAよりアミンレセプターの増幅を試みた。その結果、ドーパミンのレセプターの遺伝子を増幅し、塩基配列を決定した。昆虫のドーパミンレセプターはショウジョウバエとミツバチから報告されている7)。アゲハのレセプターのアミノ酸部分配列(422aa)はこれらの配列と59.2-56.1%の相同性を示した。鱗翅目昆虫からは今回アゲハから初めてのクローニングとなる。
アゲハふ節に発現するこれら3種のアミンレセプターについて、サザンハイブリダイゼーションによりゲノム上での構造の解析を行った。その結果、いずれのレセプターも複数コピー存在することが分かった(図9)。ゲノムライブラリーから各レセプターの配列を含むコロニーを特定したので、今後はゲノムシークエンスを解析し、ホモログの探索やプロモーター構造の解析を行う予定である。
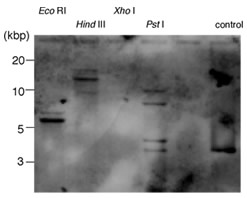 |
図9 アゲハゲノム上におけるセロトニンレセプターのサザン解析
おわりに
雌蝶ふ節領域の組織から調製したcDNAライブラリー6000クローンから味覚関連遺伝子候補と考えられる7回膜貫通GPCR1個と嗅覚結合蛋白3個が得られたことで、当初の目的は達成された。この成果は独立性が高い(70%以上)ライブラリーが得られたこと、鱗翅目昆虫の一種オオタバコガの全ゲノム配列が決定されたこと、および膜貫通蛋白構造に関する情報解析技術が進歩したからである。機能の予測は現段階では、発現部位に依存している。しかも、RT-PCRが唯一の手段である。しかし、資料として用いているふ節断片には、感覚毛以外にはGPCRを含む細胞・組織が含まれているとは考えられないので、候補遺伝子は味覚関連蛋白の遺伝子である可能性は高い。しかし、発現部位については、細胞・組織レベルの発現を測定するin situハイブリダイゼーション法を確立することが必要であり、現在研究を進めている。又、最近RNAiなど鱗翅目昆虫の遺伝子機能を解析する方法や受容体機能をin vitroで測定する方法が開発されているので、候補遺伝子の機能を直接測定する方法の開発が必要である。
cDNAライブラリーからのEST探査はほぼ飽和状態に達しているので、候補遺伝子を出発材料にゲノム遺伝子及びそのファミリーを同定する方向に方針を変え、藤山秋佐夫〈情報科学研究所〉および小原雄二〈遺伝学研究所〉両教授のご援助を受けて、アゲハゲノム6倍に相当するfosmidライブラリー(840x175=147,000クローン)を作製した。これを利用して既に候補遺伝子のゲノムクローンを分離している。
アミン類に対するGPCRは、ふ節cDNAライブラリーから3種類のクローンを分離したが、いずれも保存性の高い神経伝達型の受容体で、発現もふ節に特異的ではなく多くの組織、器官に発現している。しかし、3種ともゲノム上に複数種コピー存在することが示唆されているので、ゲノム遺伝子の解析によって味覚特異的受容体の有無を明らかにする方向を進めている。
これら味覚遺伝子ファミリーのゲノム構造が明らかになれば、近縁種であるキアゲハ、クロアゲハ、あるいは遠縁のギフチョウなどとの比較ゲノム解析を行う予定である。
参考文献
1 Nishida R, Ohsugi T, Kokubo S, and Fukami H. (1987) Oviposition stimulants of a Citrus-feeding swallowtail butterfly, Papilio xuthus L. Experientia 43:342-344.
2 Clyne PJ, Warr CG, Carlson JR. (2000) Candidate taste receptors in Drosophila. Science. 287:1830-1834.
3 Hill CA, Fox AN, Pitts RJ, Kent LB, Tan PL, Chrystal MA, Cravchik A, Collins FH, Robertson HM, Zwiebel LJ. (2002) G protein-coupled receptors in Anopheles gambiae. Science. 298:176-178.
4 Krieger J, Raming K, Dewer YM, Bette S, Conzelmann S, Breer H. (2002) A divergent gene family encoding candidate olfactory receptors of the moth Heliothis virescens. Eur J Neurosci. 16:619-628.
5 Galindo K, Smith DP. (2001) A large family of divergent Drosophila odorant-binding proteins expressed in gustatory and olfactory sensilla. Genetics. 159:1059-1072.
6 Nishida R, Ohsugi T, Fukami H. (1990) Oviposition stimulant activity of tryptamine analogs on a Rutaceae-feeding swallowtail butterfly, Papilio xuthus. Agric. Biol. Chem. 54: 1853-1855.
7 Feng G, Hannan F, Reale V, Hon YY, Kousky CT, Evans PD, Hall LM. (1996) Cloning and functional characterization of a novel dopamine receptor from Drosophila melanogaster. J Neurosci. 16:3925-3933.

