年度別活動報告
年度別活動報告書:2012年度
脊椎動物の頭部神経はどのように部域化されるのか
橋本主税(主任研究員) 西原あきは(奨励研究員)
皐 裕美(研究補助員) 伊藤賢太(大阪大学大院生)
西田 遥(大阪大学大院生)南野怜香(大阪大学大院生)
はじめに
脊椎動物の発生過程において、卵の大きさ・卵割の様式などは多種多様であるが、原腸形成運動を経て形成された神経胚から尾芽胚(咽頭胚)のかたちは種を越えて似通っている。この事実は、原腸形成運動と呼ばれる細胞の「民族大移動」によって咽頭胚と呼ばれる「共通するかたち」を作ることが脊椎動物たる所以であることを暗示するように思える。というのも、中立に導入される変異はあらゆる発生段階において中立に働くと考えられ、その結果として卵や成体の大きさやかたちの変異へと繋がるからであるのだが、原腸形成を経て形づくられる咽頭胚がここまで似ているということは咽頭胚の形成を経ることなしに脊椎動物は形づくられないと思えるからである。脊椎動物の原腸形成運動に関わる遺伝子は多数単離され、その種を越えて保存されている状況をみると進化の不思議を感じさせる。にもかかわらず、形態形成運動は種によって様々であり、遺伝子レベルの普遍性が発生過程に還元できない。ただし、原腸形成直前まで大きく異なる形態を、共通の形へと作り上げる動的過程はそもそも種によって大きく異なっているのは当然ともいえる。しかしながら、その奥底には種を越えた共通性が潜在しているとも考えられる。また神経胚から咽頭胚にかけての時期は、脊椎動物を定義するともいわれる頭部を形づくる時期であり、そのかたちが似ているということに進化的な意味を感じざるを得ない。私たちは、原腸形成および頭部形成を詳細に解析することで、進化において脊椎動物がいかにして生じたかについて知ることができるのではないかと考えている。
私たちは、脊椎動物のかたち作りを知るという目的のためにアカハライモリ(以下イモリ)とアフリカツメガエル(以下ツメガエル)を材料として研究を行なっている。これらは、脊椎動物の中でもかなり近縁であるにもかかわらず、その原腸形成様式が組織運動の方向や遺伝子発現の時期などが見かけ上かなり異なっていることから、両者の比較により質的に相同な現象を見いだすことが可能と考えており、その相同性こそが脊椎動物を通じて保存されている重要な現象ではないかと思えるからである。
また、脊椎動物の頭部構造を形づくる神経堤が形成される機構を知ることは、個体発生の過程として興味深いだけでなく系統発生の視点からも重要である。私たちは、神経堤の発生においてヌクレオチドレセプターが重要な働きをしていることを見いだしている。これまでにヌクレオチドレセプターが関わる神経堤形成機構の報告はなく、これらを詳細に解析することにより、神経堤形成を説明する新しいモデルを提唱できる可能性を考えている。ヌクレオチドレセプターP2Y4およびP2Y11のアンチセンスモルフォリノによる機能阻害実験などを行ない、これらレセプターが神経堤の形成にどのように影響するか明らかにする。
結果と考察
アカハライモリの解析から見えた両生類原腸形成に共通なモデル
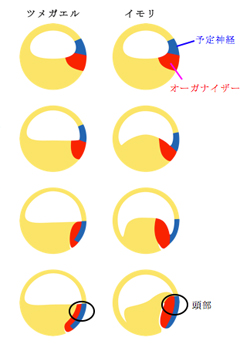
原腸形成は、我々ヒトを含む脊椎動物全般に見られる形態形成運動である。両生類の原腸形成過程では、胚の植物極側に形成された原口と呼ばれるくぼみから外側の細胞が中へ入り込み、外胚葉と内胚葉の間に新たに中胚葉の層が形成される。この中胚葉(オーガナイザー)は胞胚腔の屋根に沿うように動物極方向へと遡り、予定神経外胚葉の最前方部を裏打ちするとされている。私達は以前に、ツメガエルの原腸形成運動は、教科書的な原腸形成運動の方向性とは正反対であることを証明している1)。ツメガエルでは、原口が形成された直後の初期原腸胚期(St.10.25)で予定頭部神経外胚葉へのオーガナイザーの裏打ちは完了しており、オーガナイザーは動物極方向へ遡らずに尻尾方向へと体軸を伸ばす。そのため、ツメガエルは、イモリや他の両生類種の教科書的な原腸形成とは大きく異なる様式をとっていると考えられた。
ところがイモリ胚において、予定頭部神経外胚葉だと考えられている動物極周辺領域を原腸胚期のある時期に染色して発生させたところ、驚くことに標識したこの領域は頭部ではなく腹側の表皮に行きつくことを私たちは発見した。この観察から、「イモリ胚ではいつ予定神経外胚葉の最前方部がオーガナイザー組織に裏打ちされるのか」という疑問が生じた。これを調べるために、ツメガエルで以前になされた胞胚腔への色素注入実験1)をイモリ胚でおこなった。この実験により、イモリ胚で神経の最前方部である予定頭部神経外胚葉が内部組織に完全に裏打ちされるのが、原口が形成されてからおよそ7時間であることがわかった。イモリ胚を23℃で発生させると、原口の形成から原腸形成の完了だと言われる卵黄栓の閉鎖まではおよそ24~26時間かかるので、この裏打ちの完了は原腸形成のかなり初期の段階でなされていることをこの結果が示している。そこで、原腸形成過程の内部構造を調べるために、原口の形成からの各経過時間で胚を固定して切片にして観察した。すると、原口の形成から7時間の胚では、外胚葉を裏打ちする内部組織の最前方部は胚の赤道領域にあり、この時期の予定神経外胚葉の最前方部も同様に胚の赤道領域であることが示唆された。これを確認するために、原口の形成から7時間の胚の赤道領域を色素寒天フイルムで局所的に標識し、神経胚まで発生させた。すると予想通り、この領域は神経板の最前方部に行きついた。さらに、イモリ胚での原腸形成運動に伴うオーガナイザーの動きを見るために、脊椎動物の神経誘導因子のひとつで、ツメガエルで初期からオーガナイザーに発現するchordinの発現をin situハイブリダイゼーション法により調べた。原口が形成された0時間から2時間の胚では、原口背唇部から胞胚腔の床にかけての領域に発現が見られ、これは原口形成時点で、オーガナイザーが胚背側の表層だけでなく内部にも存在していることを示している。この後、その発現領域が外胚葉組織の覆いかぶせ運動に伴って折り込まれるようにして、7時間で予定神経外胚葉全体を裏打ちする動きが示唆された。ここから、原口形成時の胞胚腔の床の領域がおそらく本来の頭部オーガナイザーであり、現在まで頭部オーガナイザーであると考えられていた初期原腸胚の原口背唇部2)よりも、強い頭部誘導活性を持っている可能性が示唆された。これに加えて、原口形成後7時間から原腸形成が完了する24時間にかけて、何らかの組織が胞胚腔の屋根に沿って遡る様子が見られるが、この組織にはchordinは発現しておらず、これは中軸中胚葉ではない内胚葉性の組織であると考えられた。
以上の結果から、ツメガエルと同様にイモリ胚においても、予定神経外胚葉を裏打ちするためのオーガナイザーの動物極への遡りがないことは明らかで、両生類の中でも系統的にはなれている両者の原腸形成運動が基本的に似ているという事実は、両生類の原腸形成に共通なモデルを提唱させる。胞胚期にひとつの塊状に存在していたオーガナイザーは、覆いかぶせ運動により内側(頭部オーガナイザー)と外側(体幹部オーガナイザー)に分断される。そして、さらなる覆いかぶせ運動で予定神経外胚葉が上から降りてくる動きに加えて、原口が物理的特異点の役割を果たし、オーガナイザーが折り込まれるようにして予定神経外胚葉の最前方部までを裏打ちするというものである。もしかすると、この頭部決定様式こそが両生類原腸形成に重要な共通モジュールであり、いったん頭部が決まると、体軸が伸長する時期や方向性などは種ごとに多様な様式が許されているのかもしれない。イモリ胚において覆いかぶせ運動がオーガナイザーを物理的に分断するかの直接的な証明は現在進行中であるが、我々がイモリ胚において想定している動きは、ちょうど軟式テニスボールを指で押し込むようなナメクジウオの原腸形成運動3)に質的に同じ動きであることを書き添えておく。現在、イモリ原腸形成のさらに詳細な解析に加えて、広島大学両生類研究施設の協力を仰ぎ、他の多様な両生類種についても同様の解析をしていくことで、両生類普遍的な原腸形成の仕組みの理解を深め、それらを脊椎動物全般へと展開することで潜在する形態形成の普遍的な仕組みを探っていきたい。
イモリ胚における神経堤形成特異的遺伝子の発現パターン解析
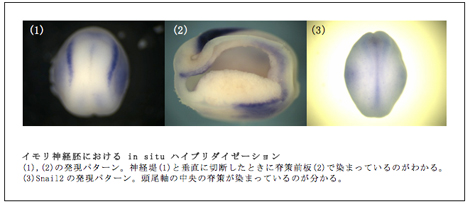
イモリとツメガエルの原腸形成機構を比較検討し共通点・相違点を明らかにするもう一つの方法論として、遺伝子発現のパターンを詳細に比較することが上げられる。そこで、まずツメガエルの神経堤形成に重要であるといわれている遺伝子Snailに着目した。神経堤領域に発現があり神経堤の発生を制御する重要な遺伝子と考えられているSnailファミリーは、イモリにおいて単離がなされておらずその解析がなされていなかったため、次世代シーケンス技術によって3つのsnailホモログであるsnail1・snail2・snail3を同定し、ホールマウントin situ ハイブリダイゼーションと組織切片作製によって、それぞれの遺伝子の発現時期や発現領域を詳しく解析した。
その結果、Snail1は初期原腸胚(st.11~12a)で、原口背唇領域を馬蹄形に発現し、ステージが進むに連れて卵黄栓を囲むようにして発現領域が変化しているのが見られた。原口が閉じて初期神経胚になると、後方の側板中胚葉と、脊索前板で発現しているのが見られた。さらに進んで、神経堤が形成し始めると神経堤領域にも発現がはっきりと見られるようになり、尾芽胚に入って頭部が形成され始めるとともに、咽頭胚に沿ったストリーム状に発現がみられることが分かった。この結果は、ツメガエルを含む脊椎動物種におけるsnailの発現に似ており、イモリにおいてもsnailが神経堤形成に重要なはたらきを有することが示唆される。また脊索前板の消失とともに脊索前板を形成していた細胞群が移動し形成する頭部間充織においても発現が見られた。ツメガエルのSnail1は脊索前板や頭部間充織での発現は見られないため、脊索前板の形成に何らかの機能を有することが示唆される。今後はモルフォリノオリゴによる機能阻害などにより、脊索前板や神経堤の形成に与える影響を解析する必要があろう。次に、Snail2は、ツメガエルやニワトリではSnail1同様神経堤に発現が見られるのに対し、イモリでは神経堤領域には見られず、脊索や神経管蓋板で発現しているのみである。最後にSnail3は、次世代シーケンス技術の解析によって神経胚以外で発現していることが分かったが、発現が弱いためin situ ハイブリダイゼーションで観察することができなかった。Snail3 については、ツメガエルはもとより他の脊椎動物においての情報も乏しいため、現時点で比較検討することは難しい。このように、イモリにおいてはsnailファミリーのうちで神経堤に発現が見られるのはsnail1のみであり、脊椎動物の神経堤形成において重要なはたらきをしているsnail1とsnail2の機能をイモリではsnail1のみが担っている可能性が示された。このように、同じ両生類の仲間であるイモリとツメガエルにおいても相同遺伝子の発現パターンが異なる結果は、今後さらに他の遺伝子や別の方法を使って比較検討していく必要性を物語る。また、今回の結果をツメガエル以外の脊椎動物(トリやゼブラフィッシュやマウスなど)と比較することで、イモリの進化的な位置づけなども見いだせるのではないかと考えられる。
ツメガエルの神経堤細胞形成におけるヌクレオチド受容体の役割
脊椎動物を定義するひとつの要素と言える神経堤の形成において、重要な転写因子やカスケードに関する解析は盛んに行われている。しかし、それ以外の視点からの解析はあまり行われておらず、細胞周期との関連が知られているのみである4)。正常な発生には適切なタイミングで適切な場所においてイベントが起こることのみならず、適切な細胞環境が整っていることが必要である。そこで、私たちは細胞周期や細胞環境の整備に関与するヌクレオチド受容体であるP2Y受容体ファミリーの中でも、将来神経堤になる領域において発現が認められるP2Y4およびP2Y11に着目し、昨年度から継続してこれらの発現パターンと機能解析を行っている。今年度は同じP2Y受容体ファミリーであるP2Y1の機能阻害胚の形態異常が、P2Y11の機能阻害胚と酷似していることから、これらの初期発生における役割に重複する部分があると予想し、P2Y1についても解析を行った。
(1)P2Y受容体ファミリーの発現パターン
P2Y受容体ファミリーであるP2Y1およびP2Y4、P2Y11に関してin situハイブリダイゼーション法を用いて、その発現パターンの解析を行った。以前から解析を行っているP2Y4とP2Y11に関しては、その発現開始時期を特定するために後期原腸胚から初期神経胚までの時期において詳細に解析を行った。その結果、P2Y4・P2Y11共に初期神経胚から頭部構造の形成において重要な役割を果たす予定頭部神経堤領域に発現が確認できた。P2Y4は発現開始時期から、頭部神経堤領域においての発現が明瞭であり、中期から後期神経胚へと発生が進む過程では頭部神経堤領域(予定外胚葉領域と予定神経領域の境界部分)に発現が限局され、尾芽胚では胚前方の背側から腹側に向かって遊走している頭部神経堤細胞での発現が認められた。また、この時期では眼や耳胞などにも発現が認められた。なお、神経堤細胞の遊走する様子は流れるように見えることからストリームと呼ばれ、耳胞から眼にかけて4本のストリームが確認できる。次に、発現開始時期においては予定頭部神経堤領域での発現がP2Y4の発現に比べ、P2Y11の発現は不明瞭であった。発現開始時期のP2Y11は卵黄栓の腹側周辺に半円を描くように強い発現が認められ、神経板を囲むように側方と前方に弱い発現が認められた。中期神経胚になると頭部神経堤領域の発現が明瞭になると同時に、将来頭部中枢神経系となる神経板前方において発現が認められた。発現領域には、嗅覚を除くレンズや聴覚などの頭部感覚器プラコード領域が含まれる。後期神経胚では脊索に発現が認められるようになり、神経褶の辺縁部に発現が限局する。初期から中期尾芽胚になると、頭部神経系と遊走する頭部神経堤細胞に発現が認められる。ただしP2Y4とは異なり、ストリームは後方にある2本しか確認できない。しかし、後期尾芽胚では頭部神経堤由来の鰓弓軟骨組織に明瞭な発現が認められ、この疑問点については今後、より詳細な解析が必要である。その他には眼および耳胞、頭部神経節、脳領域に発現が認められる。ただし、嗅覚であるセメント腺の上部には発現が認められない。また、脳領域の発現に関しては切片を用いた詳細な観察を行っていく予定である。
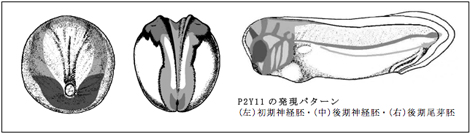
今年度から解析を始めたP2Y1については、後期神経胚以降について発現解析を行った。後期神経胚では脊索と神経板で発現が認められ、初期尾芽胚にかけて頭部神経系に発現が限局されていく。頭部神経系の中でも、眼胞での発現は明瞭に認められる。中期尾芽胚では頭部神経系の発現に加え、セメント腺に発現が認められる。しかし、セメント腺での発現は一時的なもので、後期尾芽胚になると消失する。なお、後期尾芽胚では眼と脳領域の一部、心臓に発現が認められる。なお、P2Y1はP2Y4およびP2Y11とは異なり、発生過程を通して頭部神経堤領域においては発現がみられなかった。
今後は、これら3つの発現領域のより詳細な解析と、P2Y1に関しては発現開始時期の特定を行なっていく。
(2)P2Y受容体の機能解析
これらのP2Y受容体の発現パターンから、P2Y受容体が頭部神経や神経堤及びプラコードの発生に関わっていると推察できる。そこで、それぞれのP2Y受容体の翻訳を阻害するアンチセンスモルフォリノオリゴ(MO)を作製し、その顕微注入による機能阻害胚の解析を行なった。顕微注入は4細胞期の背側の片側割球にのみ行なった。
まず、頭部神経堤で発現が確認できたP2Y11の機能阻害を行なった胚では、予想通り、頭部神経堤に由来する鰓弓軟骨組織の形成不全が見られた。そこで、頭部神経堤発生のどの時期にP2Y11が機能しているのか調べるため、各発生段階で様々な神経堤マーカー遺伝子の発現パターンの解析を行なった。その結果、神経堤発生の初期から、顕微注入を行なっていないコントロール側と比べ、機能阻害側の発生の遅延が確認された。しかし、発生が遅れているだけで、神経堤細胞の消失や遊走の異常などは確認できず、神経堤の遊走が終了したあとの尾芽胚では神経堤マーカーの発現に違いは認められなかった。このことから、神経堤が軟骨などの組織に分化する際にP2Y11が機能している可能性が考えられる。また、頭部神経堤で発現しているもう一つのP2Y受容体、P2Y4の機能阻害を行なった胚では、微弱な鰓弓軟骨組織の形成不全が認められただけで、発生の遅れは認められず、神経堤マーカーの発現にも変化は見られなかった。
初期の神経堤発生において、P2Y11とP2Y4が機能的に重複し、それぞれ単独の機能阻害ではその阻害効果がもう一方の受容体によって補完されることで、神経堤発生の初期には異常が現れない可能性が考えられるため、P2Y11とP2Y4の同時機能阻害を行なった。しかし、同時機能阻害の効果はP2Y11単独の機能阻害の効果と同等であり、鰓弓軟骨組織の形成不全は見られたが、神経堤発生初期への影響は観察できなかった。ただ、昨年度までの解析から、P2Y4には、開始コドン上流に異なる配列を持つ4種類のスプライシングバリアントを持つことが分かっている。今回P2Y4の阻害に用いたMOは、その4種類全てに共通する配列を元に作製したMOであり、その全てのmRNAの翻訳を阻害していることを期待しているが、MOによる翻訳阻害が十分でない可能性も考えられる。そのため、今後は、P2Y4のスプライシングを阻害することを目的としたMOを用いたり、薬剤処理などその他の方法を用いたりするなどして、P2Y受容体が神経堤発生の初期に影響していないか確認したい。
先に述べたP2Y受容体の発現パターンの解析では、P2Y1は頭部神経堤に発現が確認できなかった。ところが、P2Y1を機能阻害した胚でも、P2Y11の機能阻害胚同様、鰓弓軟骨組織の形成不全が見られた。このことから、後に述べる頭部神経の形成不全が、頭部神経堤の発生に影響を及ぼしている可能性も考えられる。
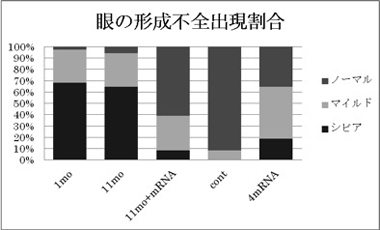
P2Y1とP2Y11は発生中の頭部神経や眼、プラコードで発現していることが観察された。それぞれの機能阻害をしたオタマジャクシでは、眼の形成不全が確認できた。重篤なものでは、眼が欠損している胚も見られた。P2Y1の眼の形成に関する機能については以前の論文で報告されているが5)、P2Y1とその受容体のリガンドの生成に関連する遺伝子との同時機能阻害をしたときに顕著な眼の形成不全が起きるという報告にとどまっている。そこで、この2つのP2Y受容体が眼の発生のどの過程に寄与しているか解析した。その結果、P2Y1の機能阻害胚でも、P2Y11の機能阻害胚でも、今回解析した限りではほぼ同様の結果が得られた。P2Y1とP2Y11とでヘテロな多量体を形成して機能するという報告があり6)、眼の形成にはその両方の受容体の機能が必要と考えられる。初期神経胚期では、機能阻害した側の神経板で、神経板マーカーのSox2の発現に顕著な変化は見られなかったが、表皮マーカーのKeratinの異所的な発現が観察された。中期神経胚期には、機能阻害した頭部領域で、アポトーシスを起こしている細胞数の著しい増加が見られた。また、神経分化マーカーのn-tubulinは頭部で発現が消失し、眼の形成に関わるOtx2やPax6は発現が低下していた。このことから、予定神経領域内で異所的に表皮様に分化した細胞が細胞死しているのではないかと考えられる。尾芽胚期には、機能阻害側で抑制性の転写因子Hesx1の発現領域が拡大していた。Hesx1は神経胚初期には予定神経前方領域の広い部分に発現し、その後発現が一部に限局して、Otx2やPax6の発現を抑制することが知られている7)。今回の機能阻害胚では、初期のHesx1が本来消失すべき場所で残り続け、Pax6やOtx2の発現を異所的に抑制することで、眼の形成不全が起きているのかもしれない。以上のことから、P2Y1とP2Y11受容体は共同して神経の維持に働き、Hesx1の発現を何らかの形で制御することで正常な頭部神経の発生に寄与していると考えられる。しかし、機能阻害胚で神経胚期に低下していたPax6やOtx2の発現は、尾芽胚期にはその発現の変化は一時的に観察できなくなった。これに関してはより詳細な解析が必要である。
興味深いことに、P2Y4 mRNAを顕微注入し、P2Y4を異所的に神経領域に発現させた胚でも眼の形成不全が観察できた。ヒトのP2Y4とP2Y11ではcAMPの制御が正反対であるという報告がある8)9)ため、アフリカツメガエルにおける眼の発生にP2Y1とP2Y11の下流のcAMPの制御が重要な可能性がある。
終わりに
これまではツメガエルと正反対であると考えていたイモリの原腸形成運動を詳細に解析したところ、視点を少しずらすことで非常に似た様式であることに気付かされる。これは、中軸中胚葉が胞胚腔の屋根をさかのぼらないというツメガエルでも見られた事実に加え、特に前方部のオーガナイザー領域が外部から陥入して予定神経外胚葉と接するのではなく、元々から胚の内部領域に形成され予定頭部神経領域と早い時期から接する仕組みであるというまったく新しい仮説を導く。オーガナイザーをこのように考えることは、脊椎動物の原腸形成過程に新しい視点を導入することにも繋がると期待できる。神経堤形成をイモリにおいて解析するとっかかりとして、多くの脊椎動物の神経堤形成において重要であることが知られているsnailファミリー遺伝子の発現パターンを解析したところ、snail遺伝子の機能はsnail1によってのみ担われているらしいことが示された。これは神経堤形成とsnail遺伝子の関係について系統的に考える新たなきっかけとなる。また神経堤同様に脊椎動物の頭部形成に重要であると考えられている脊索前板・頭部間充織にsnail遺伝子が発現しているという事実は脊椎動物の進化を考える上で興味深い。P2Y遺伝子産物が神経堤形成に関わることなども含めて両生類を通じて神経堤形成機構を見直すことは脊椎動物の系統発生を考える上で重要であろうし、その過程での細胞運動と遺伝子発現様式を動的に関係づけることによって違いの中の相同性を見いだせるきっかけとなろうことを期待させる。
引用文献
- 1)Koide T, Umesono K, Hashimoto C.(2002) When does the anterior endomesderm meet the anterior-most neuroectoderm during Xenopus gastrulation? Int J Dev Biol.
- 46:777-783.
- 2)Kaneda T, Iwamoto Y, Motoki JY. (2009) Origin of the prechordal plate and patterning of the anteroposterior regional specificity of the involuting and extending
- archenteron roof of a urodele, Cynops pyrrhogaster. Dev Biol. 334:84-96.
- 3)Yu JK, Satou Y, Holland ND, Shin-I T, Kohara Y, Satoh N, Bronner-Fraser M, Holland LZ. (2007) Axial patterning in cephalochordates and the evolution of the organizer.
- Nature. 445:613-7.
- 4)Nagatomo K, and Hashimoto C (2007) Xenopus hairy2 Functions in Neural Crest Formation by Maintaining Cells in a Mitotic and Undifferentiated State. Dev. Dyn. 236:
- 1475–1483
- 5)Masse K, Bhamra S, Eason R, Dale N, Jones EA (2007) Purine-mediated signaling triggers eye development. Nature 449:1058-1062
- 6)Ecke D, Hanck T, Tulapurkar ME, Schafer R, Kassack M, Stricker R, Reiser G (2008) Hetero-oligomerization of the P2Y11 receptor with the P2Y1 receptor controls
- the internalization and ligand selectivity of the P2Y11 receptor. Biochem J 409:107-116
- 7)Ermakova GV, Solovieva EA, Martynova NY, Zaraisky AG (2007) The homeodomain factor Xanf represses expression of genes in the presumptive rostral forebrain that
- specify more caudal brain regions. Dev Biol 307:483-497
- 8)Communi D, Motte S, Boeynaems JM, Pirotton S(1996) Pharmacological characterization of the human P2Y4 receptor. Eur J Pharmacol. 19;317(2-3):383-9.
- 9)Communi D, Govaerts C, Parmentier M, Boeynaems JM (1997) Cloning of a human purinergic P2Y receptor coupled to phospholipase C and adenylyl cyclase. J Biol Chem
- 19;272(51):31969-73.
