年度別活動報告
年度別活動報告書:2010年度
脊椎動物の頭部神経はどのように部域化されるのか
橋本主税(主任研究員) 皐 裕美(研究補助員)
益田真都香(大阪大学大学院生
はじめに
脊椎動物の個体発生過程をつぶさに観察すると、咽頭胚と呼ばれる時期にその形状が種を超えて高度に保存されていることに気付く。この事実から考えられることは、咽頭胚の「形状」を構築する仕組みに脊椎動物を通じた普遍的な機構が潜在するからであろうと考えられ、またその普遍性こそが脊椎動物の脊椎動物たるゆえんであろうと考えられる。無脊椎動物から脊椎動物が出現した時に獲得した進化的な拘束が、咽頭胚というかたちとして具現化していると言ってもあながち誤りとは思えない。さて、脊椎動物の胚発生を受精から経時的に観察すると、卵の大きさや形、あるいは細胞分裂様式など種によって様々であり、そこに見かけ上の普遍性は見いだせない。というよりも、種ごとに好き勝手に発生しているようにさえ感じる。しかし、それら形態的にも多様な胚が原腸形成過程を経る事により神経胚となり咽頭胚を形づくること、さらには原腸形成過程に関わる鍵となる遺伝子群が種を超えて保存されると考えられている事などから、原腸形成過程が脊椎動物の形づくりにとって最も重要であると予想される。
私たちは、脊椎動物のかたち作りを知るためにアカハライモリ(以下イモリ)とアフリカツメガエル(以下ツメガエル)を実験材料として研究を行なっている。その理由は、系統的に見て脊椎動物の中でもかなり近縁な種であるにもかかわらず、その原腸形成様式が組織運動の方向や遺伝子発現の時期などの視点から互いにかなり異なっていることが明らかとなっている為、両者の比較から見いだされる相違性を排除した結果として残る質的に相同な現象こそが脊椎動物を通じて保存されている重要な現象ではないかと思えるからである。
今年度には、第一に、両生類の原腸形成機構を知る為の準備としてイモリの初期発生過程に特異的に発現する遺伝子の同定とin situハイブリダイゼーション法の改良、第二に、神経堤やプラコードの成立機序を明らかとする目的で、初期神経胚の神経板境界領域に発現が認められる、ヌクレオチドレセプターP2Y4およびP2Y11の単離とその発現パターン解析、アンチセンスモルフォリノによる機能阻害実験などを行なった。
結果と考察
(1)イモリ神経胚特異的遺伝子の単離と発現パターンの解析
私たちは、イモリとツメガエルの研究から、近縁であると考えられる両者の原腸形成過程は空間的時間的にかなり異質であることを明らかにしている(Koide, Umesono and Hashimoto, 2002)。この違いの重要な点は、例えば体軸を伸ばす方向についてみると、イモリとゼブラフィッシュでよく似ており、またツメガエルとニワトリでよく似ているという具合に、イモリとツメガエルの原腸形成過程は、それぞれに脊椎動物の他の種との相同性を示すところである。したがって、イモリとツメガエルの原腸形成過程における遺伝子発現や組織の運動などを詳細に比較検討することにより、脊椎動物に共通な仕組みをかいま見ることができるのではないかと期待を抱かせる。
歴史的に見て、イモリは胚移植など実験発生学的な知見が多く、ツメガエルは遺伝子の働きなど分子生物学的知見が多い。これまでは(現在でも)、両者の原腸形成過程は同じ機構であると信じられていた為に、ツメガエルで得られた遺伝情報をイモリの動きに載せて理解されてきたのだが、両者の原腸形成運動が180度異なることが分かった今では、実験発生学をツメガエルで、分子発生学をイモリで行なう必要が生じている。たとえばオーガナイザーが形成される時期と場所、オーガナイザーの働き、原腸形成運動、神経誘導の時期と場所など、イモリとツメガエルの間では、予備実験のデータから見てもかなり異なっていると考えられる事象が多く、例えばホルトフレーターの移植実験など(Hamburger, 1988)をツメガエルで再現しようと試みると、イモリとはまったく異なる融合胚を形づくるなど、ツメガエルとイモリ、あるいはその他の両生類の実験結果をまとめて解析する事は問題を無駄に複雑にすると考えられるからである。今年度は、これらの点についてイモリとツメガエルの実験材料としての問題点や、これまで蓄積されて来たデータの性質などを詳細に検討し、これからの実験の準備となる基礎的なデータを予備実験的に集める事を行なって来た。まず初めに、イモリの形態形成運動を知ることを目的として、原腸胚・神経胚で特異的に発現する遺伝子の発現パターンを解析することを目指した。ツメガエルの相同遺伝子を用いた発現パターンの解析、特に経時的な変化の解析などにより、特定の遺伝子が発現する領域と別の遺伝子の発現する領域の相対的な移動が明らかに示されており、また、特定の機能を担う遺伝子の発現時期を知ることにより、その機能領域が構築されるのかの指標にもなっている。たとえば、神経領域の特異的マーカー遺伝子でも初期原腸胚で発現が始まるもの(たとえばxhairy2やXotx2など)から後期原腸胚(foxG1やdlx5など)、あるいは神経胚(pax8やpitx1など)でその発現が始まるものまでさまざまであるが、予備実験の結果によるとイモリではこれらの遺伝子の発現様式がツメガエルとは異なっていることが示されている。したがって、さらに数多くの遺伝子の発現時期とパターンの推移を詳細に解析し、ツメガエルと比較することで新たな知見が得られると私たちは考えている。
この目的の為に、まずin situ ハイブリダイゼーション法の検討を行なった。特にイモリ胚はツメガエル胚と比較して大きく、胞胚腔が変形しやすい為に、固定法の検討を行ない、また胞胚腔の変形により染色ムラが生じたりすることもあったことから、これらの改善を行なった。さらに、発色の基質や基質の発色を増強させる試薬などの確認も行ない、イモリ胚に最適の実験条件を構築している。またツメガエルとは異なり、イモリの遺伝子はその配列が未同定のものも多く、そのため、イモリに関しての遺伝子発現の解析や顕微注入による遺伝子の異所的発現・機能阻害といった分子生物学的実験はほとんど行なわれていない。上述したように原腸形成運動をイモリとツメガエルで比較するためには、原腸形成運動に関わる因子の発現や機能を解析し、種々の組織マーカーで細胞の動きを追うなどが必要となってくる。そこで、イモリ初期胚で発現するRNAから、解析に必要と考えられる遺伝子を網羅的に単離することを進めている。方法としては、まずイモリの神経胚期に特異的に発現する遺伝子の単離を目指す為、イモリ初期原腸胚からcDNAライブラリーを構築し、それを鋳型としてビオチンで標識したアンチセンスRNAを合成し、イモリ神経胚から得られたpolyA+RNAと溶液中でハイブリダイゼーションをC0t値1000以上となる条件で行なわせ、ストレプトアビジン添加後のフェノール処理によって神経胚特異的に発現するRNAを濃縮した。このRNAを次世代高速シーケンス技術により網羅的に配列の解析を行なっている。この方法で得られた新規遺伝子を用い、今後さらにイモリの遺伝子の発現を解析する事で、ツメガエルとの相違点が多く見いだせる事が期待できる。また、cDNAの配列を元にmRNAの合成やモルフォリノアンチセンスオリゴの設計を行い、イモリ胚へ導入し、遺伝子の機能解析を行なっていくことも可能となるが、現時点ではイモリ胚へDNAやRNAを顕微注入する方法は確立されていないので、今後その実験法も確立しなければならない。
(2)ヌクレオチドレセプターP2Y4およびP2Y11の解析
脊椎動物の頭部は、無脊椎動物の頭部と比較して極めて特徴的な構造をしており、「真の頭部」と言われ、脊椎動物を定義する構造であると言われることもある。脊椎動物の頭部は、頭部骨格に囲まれた中枢神経系(すなわち脳)と神経堤およびプラコード細胞にそのほとんどの構造は由来する。最終的に終脳・間脳・中脳・後脳といった領域に分かれる脳と、頭部および体幹部に分けられる神経堤細胞の成立は、頭部構造ができる前にあたる発生の非常に初期の段階(初期原腸胚)でおおまかに決定されている。これら領域の決定にはさまざまな転写因子が関わっており、それらが領域特異的にカスケードをつくることで各領域が特徴づけられる。このことから脳の領域決定においては転写因子が各領域のマーカー遺伝子として非常によく研究されている(Sasai, 2001; Wigle and Eisenstat, 2008)。
私たちはこれまでに、脊椎動物を規定するともいえる神経堤とプラコードの形成機構について解析を進め、転写因子のカスケードではなく、細胞周期の状態を制御する事により神経堤とプラコードが形成されることを明らかにして来た(Nagatomo and Hashimoto, 2007, Murato and Hashimoto 2009) 。この考え方の主となる点は、神経板と表皮の運命が決まる時(ツメガエルでは初期原腸胚)において、神経と表皮の境界領域は運命決定がなされず、したがって多分化能を有した未分化な状態を維持する事により、神経堤やプラコード特有の能力(将来的に骨・神経節・間充織・色素細胞など多種多様な細胞へと分化する能力)を有する事ができ、その細胞内の状態がなければいかなる転写因子が存在しようとも下位のカスケードは動かず、結果として神経堤もプラコードも形成されないという事にある。この点について異なる方向からの解析を進める為に初期神経胚の神経堤領域に発現する新規遺伝子P2Y4とP2Y11を見いだし、その初期発生における発現パターンを解析した。その結果、P2Y4は後期原腸胚期で予定神経堤とプラコード領域にその発現が認められ、その後、頭部神経と神経堤由来の組織にその発現が引き継がれることが示された。またP2Y11は、初期原腸胚期では中胚葉領域に発現が認められ、後期原腸胚期になると頭部プラコードと最前方部神経領域に発現が限局する。
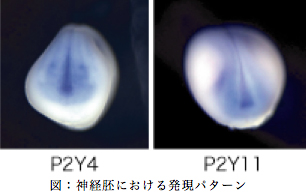
神経胚では、神経堤の一部と頭部プラコードそれに神経版の予定終脳領域に強い発現が起こり、尾芽胚期以降では神経堤・脳・耳胞や眼など、その細胞に由来する組織へと発現が維持される。この発現パターから、この二つの遺伝子が神経堤・プラコードや頭部神経の形成に必要であることが示唆されるので、次にアンチセンスモルフォリノ(MO)を用いて機能阻害を行ない、その形態形成に与える影響を解析した。その結果として、P2Y11に関しては、神経堤と頭部神経に関わる遺伝子発現に影響を与え、さらにオタマジャクシの頭部が縮小し、レンズの形成が抑えられることが分かった。P2Y4の機能阻害胚では、全体的に明らかに影響が認められるものの、その効果はあまり強いものとはいえなかった。ツメガエルは偽四倍体であり、同じ遺伝子を2種類持つことが知られており、実際に元々同じ遺伝子であったものが、偽四倍体であるが故の重複によってその塩基配列はいうに及ばず、発現時期やパターンが変化することも知られている(Murato, Nagatomo, Yamaguti and Hashimoto 2007)ため、偽対立遺伝子座に存在する遺伝子間の配列に差異が生じ、MOがアニールする配列に影響を与え、結果としてMOによる機能阻害が完全ではなかった可能性が浮上した。そこで、mRNAの5’領域の解析を行なったところ、今のところ偽対立遺伝子の違いによるものか、スプライシングの違いによるものなのか、あるいはその両者によるものなのか不明ではあるが、開始コドン付近の配列が異なる4種類の転写産物の存在が確認できた。現在は、これらの配列に効果を持つと考えられるMOをデザインし、あらためて機能阻害の影響を考察している。
ヌクレオチド受容体をコードすると考えられるこれら遺伝子群の、現時点で推測されている働きとして、細胞の未分化性の維持に関わる事がいわれている(Greig, Linge and Burnstock, 2008)為に、我々の仮説を支持する重要な分子の一つであるかもしれない。また、P2Y1は眼の形成に重要であることも知られており(Masse K, et.al. 2007)、ヌクレオチドレセプターと頭部構造の形成には緊密な関連があるのかもしれない。さらにP2Y11は細胞極性の形成に関与するという報告(Shindo, Hara, Yamamoto, Ohkura, Nakai and Ueno, 2010)もあり、移動する細胞としての神経堤やプラコードに発現する事実は興味深い。
おわりに
ここまで脊椎動物の体づくりの仕組みを、イモリとツメガエルを用いた解析の進捗状況として簡単に紹介した。今後は、イモリにおける遺伝子発現の解析や既知の遺伝子の働きを調べ、またツメガエルに実験発生学的方法論を駆使することで、イモリとツメガエルの本質的な相違点と相同点を見いだして行き、その中に神経堤やプラコードの形成機構に関する成果などを当てはめることにより、ゲノムが包含する「脊椎動物の形態」を進化的な視点も含めて考察して行きたい。
余談だが、昨年度まで進めてきたUCP2遺伝子の機能解析およびオーガナイザー領域の解析に関しては、かかる研究に従事していた者がそれぞれ9月と6月に研究室を離れた為に現時点での進行が完全に止まっている。特にUCP2に関してはかなりの実験が進んでいたところだったので、現在の実験に余裕が出てきたらできるだけ早期に研究の再開を計画したい。
参考文献
1)Greig AV, Linge C and Burnstock G, (2008) “Purinergic receptors are part of a signalling system for proliferation and differentiation in distinct cell lineages in human
anagen hair follicles” Purinergic Signal. 2008 Dec;4(4):331-8
2)Hamburger V. (1988) ”The Heritage of Experimental Embryology: Hans Spemann and the Organizer” Oxford Univ Pr on Demand
3)Koide T, Umesono K, Hashimoto C. (2002) When does the anterior endomesderm meet the anteriormost neuroectoderm during Xenopus gastrulation? Int. J. Dev. Biol.
46:777-783.
4)Masse K, et.al. (2007). Purine-mediated signalling triggers eye development. Nature 449:1058-1062.
5)Murato Y. and Hashimoto C. (2009) "Xhairy2 functions in Xenopus lens development by regulating p27xic1 expression" Dev. Dyn. 238:2179-2192
6)Murato Y. Nagatomo K, Yamaguti M and Hashimoto C. (2007) "Two alloalleles of Xenopus laevis hairy2 gene―evolution of duplicated gene function from
a developmental perspective." Dev Genes Evol. 217:665-673
7)Nagatomo K. and Hashimoto C. (2007) "Xenopus hairy2 functions in neural crest formation by maintaining cells at mitotic and undifferentiated state" Dev.Dyn.
236:1475-1483
8)Sasai Y. (2001). Roles of Sox factors in neural determination: conserved signaling in evolution? Int J Dev Biol 45:321-326.
9)Shindo A, Hara Y, Yamamoto TS, Ohkura M, Nakai J, Ueno N, (2010)”Tissue-tissue interaction-triggered calcium elevation is required for cell polarization during Xenopus
gastrulation” PLoS One. 2010 Feb 2;5(2):e8897.
10)Wigle JT, Eisenstat DD. (2008). Homeobox genes in vertebrate forebrain development and disease. Clin Genet 73:212-226.
