年度別活動報告
年度別活動報告書:2006年度
脊椎動物の頭部神経はどのように部域化されるのか
橋本主税(主任研究員) 阿草耕介(研究スタッフ)
皐裕美(研究補助員) 永友寛一郎(大阪大学大学院生)
村戸康人(大阪大学大学院生)
はじめに
生きものの形はゲノムの情報によって成立する。だから究極的には、「ゲノムの形」が「生きものの形」へと変換する機構を私たちは知りたい。だが、直面する問題として私たちが興味を持っているのは「脊椎動物の頭部がどのようにできあがるのか?」である。
線虫やホヤの初期発生を見ると、非対称分裂によって異なるタイプの細胞を作りだし、その繰り返しによって形を作っている。見るからに機械的である。このタイプの生きものは、初期胚の細胞系譜をかなりのところまで追いかけることができ、胚のどの細胞が成体のどの組織へと分化するのかについても良く理解されているため、生きものを機械論的に理解する研究材料としては非常に魅力的である。逆に、細胞数が爆発的に多い脊椎動物などでは、一つ一つの細胞は大した意味を与えられていない。機能を持つのは細胞集団でありその集団によって形作られる領域である。その細胞集団を形成する細胞群も確率論的に決められているに過ぎない。したがって、「この辺りにいる細胞は、将来的にはこの領域に入り、このように分化する傾向がある」ことは分かるが、では個別にどの細胞がどのような運命をたどるのかについては全く予測できない。ある領域の細胞群が特定の誘導を受けても、ある細胞はその誘導に応答して特定方向に分化を始めるが、隣接する別の細胞は全く応答しないで、結果としてその領域では二種類の細胞がゴマシオ状態になることは脊椎動物の発生では頻繁に起こる。結局のところ、膨大な数の細胞の運命を一つ一つ決めていくことは不可能であるために、確率論的な発生機構を進化の過程で採用したのであろう。このような生きものでは、機械論的な考え方はなかなか当てはめにくい。むしろ、細胞の社会学を考えるしかない。ただ、ここで言っておきたいことは、非常に曖昧な決定過程をたどってできあがる個体そのものは非常に厳密であると言うことで、発生過程には機械にない「しなやかさ」を持っていることが生きものの面白いところである。
私たちは、脊椎動物の頭部神経がどのようにできあがるかについて、アフリカツメガエル(以下ツメガエル)を材料として研究を行なっている。ツメガエルの神経形成過程では、まずオーガナイザーと呼ばれる組織が決定的に重要であることが知られている(1)。オーガナイザーは、初期原腸胚において予定神経外胚葉と接して神経誘導と部域化を行なう(2)。その後、原腸形成運動に伴ってオーガナイザーは咽頭内胚葉・頭部内胚葉・脊索前板・脊索・底板などに形を変え頭部神経のより詳細な領域化に貢献する。神経誘導と同時に予定領域が決まる神経堤とプラコードも頭部神経の形成に重要な役割を持つ。神経堤細胞は尾芽胚以降に移動して頭部骨格や神経節などを作り、プラコード細胞も頭部神経や神経堤と共同して感覚器や神経節を作り上げる。これらに加えて脊索前板は、神経胚までは前脳のパターン形成に二次的に関与するが、尾芽胚になるとその構造は消滅して個々の細胞がバラバラになって移動を始め、頭部の間充織 や結合組織となる。このように、頭部神経ができあがる仕組みを知るためには、中枢神経系の細胞に加えて、周辺組織の細胞群を同時に解析する必要がある。
私たちは、Xhairy2と呼ばれる遺伝子を指標として頭部神経形成機構に迫ろうとしている(3)。この遺伝子は、オーガナイザーの他、脊索前板・底板・神経堤・プラコードなどに発現が限局しており、これら組織の形成に極めて重要であることが分かっている。この遺伝子は、bHLH型の転写因子をコードしているが、この翻訳産物自体が二重機能タンパクとしてオーガナイザーのパターン形成に重要であることが分かっている(4)。また、二つのコピー遺伝子が存在しており、蛋白質としての働きも含めてこれらコピー遺伝子の存在によって形態形成を制御している可能性も示唆されている。
私たちは、細胞が集団となり、社会を作って個体の形を作っているところに興味を持っている。だから、ある遺伝子の働きについて調べる場合に、その遺伝子の上流と下流(すなわちカスケード)を解析することに特段の興味はいだかない。むしろ、その遺伝子を発現する細胞が他のどの種類の細胞と形態形成運動の過程で出会い、どのように相互作用をしながらどのようなかたちを作り上げていくのかについて興味を持っている。特定の遺伝子がどういう働きをするのかについても、細胞同士が移動し相互作用し合う文脈においてのみ興味を持つのである。その遺伝子を発現することはその細胞の一つの個性であり、様々な個性を持っている細胞たちが正確な運動を経ながら互いに接し、また離れて種々の細胞へと分化し、形を作っていく。その過程を総合的に理解することを目指している。しかし、私たちが用いているのは古典的な実験発生学と分子生物学の方法論であるので、細胞や組織の相互作用を全体として認識することに困難が生じる場合も多い。この点を打破するために発生過程の胚の3次元画像データを構築することを試みている。初期発生過程は、潜在的領域が形態学的には見えない時期であり、遺伝子の発現パターンや細胞増殖の頻度、あるいは分化誘導シグナルを受けている領域などを実験発生学的に染色することで、形態学的に潜在する領域を知る他ないのだが、ツメガエル胚は不透明であり、細胞の運動などもリアルタイムで観察することはできない。したがって、胚の内部情報を切片から二次元情報として取り込み、それを立体構築することで3次元的(時間を含めて4次元的)に記載する方法論が確立すれば客観的な記載が可能となり、他の研究によって得られた既存のデータをこれまで以上に活用できる可能性がある。
結果と考察
(1)Xhairy2は予定神経堤細胞のコンピタンスを維持する(5)。
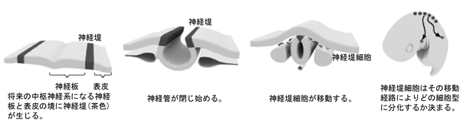
生きものの形づくりは、その構成要素である細胞の増殖・分化の制御に依存する。脊椎動物の神経堤細胞は神経管背側に位置し幹細胞のような性質を持つ。神経管が閉じ始めると、神経堤細胞は盛んに分裂を繰り返しながら胚体内を広く移動し、末梢神経や神経節・顎の骨など驚くほど多様な種の細胞に分化する。この神経堤は発生のきわめて初期に、将来の神経領域と表皮領域との境に生じ、周りの細胞より遅い時期まで未分化性を維持する(図1)。
図1
神経堤が生じる機構に、BMP・Wnt・FGF・Notch等の細胞外シグナル経路やその下流で働くことが予想される転写因子の関与が知られている (6)。しかし、それらがどのように神経堤を形成し未分化状態を維持させるのかはよくわかっていない。我々が注目するXhairy2は、神経堤が形成される以前から未分化な外胚葉全域に発現しており、発生が進むにつれその発現は神経堤に限局していく。また、Xhairy2の属するHESファミリー因子は様々な組織の形成に関与する。特に中枢神経系では神経分化の抑制に極めて重要な役割を果たすことが知られており (7) 、神経堤でも同様の分化抑制に働くことが期待される。これらのことからXhairy2は神経堤が生じる過程で機能することが予想される。
そこで、本研究ではアンチセンスモルフォリノオリゴを用いて、Xhairy2の機能を神経堤特異的に阻害し、その影響を観察した。その結果、発生の早い時期に予定神経堤マーカーであるSlug・Foxd3の発現が消失していた。さらにXhairy2機能阻害胚では神経堤細胞に由来する、頭部末梢神経・鰓の骨・ヒレ・色素細胞の減少もしくは欠損が観察された。機能阻害の影響が極めて早い時期に観察されること、神経堤由来の組織全般に形成不全が観察されることから、Xhairy2は神経堤が生じる時期から神経堤の形成に必須であることが示唆された。
次に、Xhairy2が神経堤でどのような働きを持つか検討した。まず、Xhairy2は神経分化抑制に働くことが知られているので、Xhairy2機能阻害胚で神経分化に関与する遺伝子の発現を調べた。その結果、神経分化マーカーの発現は神経堤では変化していなかった。しかし神経分化に関与し細胞周期を阻害することが知られるp27xic1(8)の著しい発現が、本来発現していない神経堤を含む領域で観察された。また、このp27xic1の異所的発現と一致して細胞増殖の減少・アポトーシスの増加が観察された。さらに異所的なp27xic1は初期神経堤マーカーの発現を減少させた。以上のことから、細胞周期を妨げて分化促進に働く(もしくはアポトーシスを引き起こす)ことが知られるp27xic1の発現をXhairy2が抑制することが、正常な神経堤形成に必要であると考えられる。このことはXhairy2が予定神経堤領域を未分化状態に維持することで神経堤の形成に働く可能性を支持する。このXhairy2によるp27xic1の抑制は、外胚葉が未分化な、発生の極めて初期から起こることから、Xhairy2は外胚葉の増殖・未分化性の維持に神経堤の形成以前から機能することで予定神経堤になりうる細胞の維持に関与しているかもしれない。これまで多くの研究が、神経堤を直接誘導する分子機構に注目している。一方で、本研究はその誘導に対する応答能を確立する分子機構に迫る一助になると考える。
(2) Xhairy2遺伝子は重複によって相補的機能分化を起こしている(9)。
遺伝子の重複は、生物が形質の多様性を獲得するための重要な進化上の戦略である(10)。このモデルでは、オリジナル遺伝子がその本来の役割を果たしているという条件の元で、重複されたもう一方のコピー遺伝子は様々な変異を蓄積することができるとされている。これに対して、重複退行相補(Duplication-Degeneration-Complementation; DDC)モデルでは、重複遺伝子をペアと考え、そのそれぞれのコピーが、相補的に退行性の変異を蓄積する結果、ペアとしてようやく遺伝子の祖先的な役割を保持できるので、両コピーともにゲノム上に固定されると説明される(11)。偽四倍体生物であるツメガエルには一つの遺伝子についてコピー遺伝子が存在し、コピー間で機能の差はないと考えられている。
Xhairy2bは、底板・前方部脊索前板・神経堤の形成を制御しているが、底板ではa・b両方が、前方部脊索前板と神経堤ではbのみが機能していることが特異的機能阻害の結果から明らかとなった。また、母性転写産物はa のみであり、発生過程で新規に転写されるものの多くはbであるという時間的発現制御を受けることが示された。さらに、a・bの空間的な発現パターンを、in situハイブリダイゼーション法で特異プローブを用いて精確に比較したところ、神経胚の神経堤での発現はbによるものであり、また、底板では、a・bともに発現していることが明らかとなった。これらの事実は機能阻害の結果をうまく説明できる。予定感覚器プラコード領域でのXhairy2は、予定前脳領域にも重なって発現しているが、より外側の発現がb、内側の発現はaであった。このようにaとbは底板以外では相補的に機能を失っており、二つあわせてXhairy2として機能している事実を考えれば、DDCモデルを支持していることが示唆される。
また、新機能付与に関して面白い事実を見いだしている。5'UTR-ORF(uORF)がbにのみ存在し(二倍体のXenopus tropicalisのhairy2にもない)、低い割合で30アミノ酸のペプチド(以下、30AA)が翻訳されている。この30AAは分泌性のシグナルペプチドであることが、Chordinの分泌シグナルを30AAで置換した実験から示されている。近年のゲノムデータベース検索研究から、uORFは決して珍しいものではないことが判明しており(12)、また、ヒト細胞における網羅的なタンパク質の質量解析から、uORFから翻訳されたとみられる30AA程度の非常に小さなタンパク質が数多く見いだされていることも分かってきている(13)ことを踏まえると、Xhairy2に存在するuORFの機能を知ることは重要であるかも知れない。
(3) ツメガエル胚発生過程の3D画像構築
ツメガエルの3次元情報をコンピュータ内に取り込み、時系列に沿った胚発生過程のシミュレーションを行うことを私たちは目指している。
まず発生過程のシミュレーションを考えるに当たって、コンピュータ内に正確なツメガエル胚の立体情報を取得する必要がある。生体の3次元立体像を再現するためには、従来CTスキャナ、MRI、共焦点レーザー顕微鏡と言った機器を用いて断層像を自動ないし、半自動的に取得し、3次元的に可視化する方法が用いられてきた。しかしながら、CTスキャナやMRIはサンプルの大きさに限界があり、ツメガエル胚のような直径1mm程度の試料には適しておらず、また、共焦点顕微鏡では逆により小さく、また外形が透明である試料での使用に限られていた。
このような問題点を克服するために、私たちは3次元内部構造顕微鏡(14)を用いることとした。これは断層像を撮りたい試料を樹脂で包埋し、ミクロトームを用いて切削しながらその断面を固定した撮影装置で直接撮影することで、一連の断層像を取得する方法である。この方法の利点は、選択するレンズによって撮影する試料の大きさに制限が無いこと、定点で撮影するので後に画像群の位置合わせが不要であること、カラー情報を取得できること(今回の撮影法では、試料の特性からグレースケールのみとなる)が挙げられる。
理化学研究所(15)や食品総合研究所(16)を基本として、私たちの目的に適った装置を開発した。例えば、ツメガエル胚のような内部に中空がある試料の場合、通常の顕微鏡観察では断面のみならず、奥情報も同時に取得することになるため、奥情報を一切除外した断面像だけを特異的に撮影することを可能とする、ガラスや鏡などの表面構造を観察するための装置である同軸落射照明装置を用いたことは改良点のひとつである。
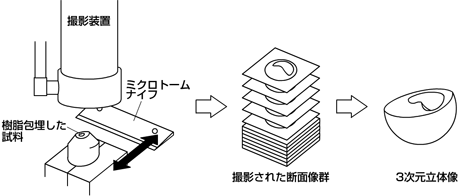
図2. 3次元内部構造顕微鏡の作業手順
ソフトの面での工夫は、断層像に存在する多数の傷を半自動的に除去するためのプログラムを開発した点である。その結果、以下のような内部構造を含めた3次元立体像をコンピュータ内に再現することができた。再現された3次元立体像はコンピュータ内で自由に移動・回転・拡大/縮小することが可能であり、また、自由に面で切り取って表示することができる。
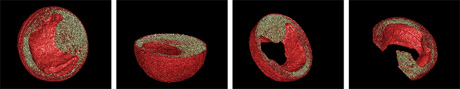
図3. ツメガエル胚の3次元表示
今後は、胚発生の時系列に沿ってデータを追加していく。さらに、本来外部からは観察することができない胚内部での遺伝子がどのような領域で発現しているのかを確認するために、現在の立体形状に新たに遺伝子発現の部位情報を加えていく。また、立命館大学光量子発生科学研究室の山田教授が開発した卓上シンクロトロン・MIRRORCLE(17)を用いた新しいX線マイクロCT顕微鏡を用いる実験も試みる。この方法により、従来では生体のままでは観察できなかったツメガエル胚の高解像度断層像を取得し、試料を損なうことなく一連の内部構造の時系列変遷を立体的に観察することが期待できる。
おわりに
本報告では、Xhairy2が神経堤形成をどのように制御するかについて述べたが、同様の制御機構がプラコードや脊索前板にも働いている結果も私たちは得ている。この三者が持つ共通の性質として、「比較的後期になってから移動し、その場所に応じた分化を行なう」ことがあげられる。これはとりもなおさず最終的に分化するまでは「多分化能」を維持し続けなくてはならないことを示す。一般に、細胞の増殖と分化は表裏であると言われているが、多分化能を維持するためにXhairy2が細胞周期を維持している事実はこの問題を解くのにひとつの意味を与えていると感じる。Xhairy2、ひいてはhes遺伝子群をキーワードとして、脊索前板・神経堤・プラコードの共通理解に到達できないかについて考察を試みることは重要であろう。
参考文献
1) Spemann, H. and Mangold, H. (1924) Wilhelm Roux's Arch. 100: 599-638
2) Koide, T., Umesono, K and Hashimoto, C (2002) When does the endomesoderm meet the anterior-most neuroectoderm during Xenopus gastrulation? Int. J. Dev. Biol.
46: 777-783
3)Tsuji S, Cho KW, Hashimoto C. 2003. Expression pattern of a basic helix-loop-helix transcription factor Xhairy2b during Xenopus laevis development. Dev. Genes Evol
213: 407-411.
4) Murato, Y., Yamaguti, M., Katamura, M. Cho, K.W.Y and Hashimoto, C. (2006) "Two modes of action by which Xenopus Hairy2b establishes tissue demarcation in Spemann's
organizer." Int. J. Dev. Biol. 50: 463-471
5) Kan-ichiro Nagatomo1 and Chikara Hashimoto "Xenopus hairy2 functions in neural crest formation by maintaining cells at mitotic and undifferentiated state" (submitted)
6) Huang X, Saint-Jeannet JP. (2004) Induction of the neural crest and the opportunities of life on the edge. Dev Biol 275: 1-11.
7) Kageyama R, Ohtsuka T, Hatakeyama J, Ohsawa R. (2005) Roles of bHLH genes in neural stem cell differentiation. Exp Cell Res 306: 343-348.
8) Vernon AE, Devine C, Philpott A. (2003) The cdk inhibitor p27Xic1 is required for differentiation of primary neurones in Xenopus. Development 130: 85-92.
9) Yasuhito Murato, Kan-ichiro Nagatomo, Mami Yamaguti and Chikara Hashimoto "The two alloalleles of Xenopus laevis hairy2 gene - Evolution of the duplicated gene function
in the developmental perspective." (submitted)
10) Ohno S (1970). Evolution by Gene Duplication. Berlin, Springer-Verlag.
11) Prince V E, Pickett F B (2002) Splitting pairs: the diverging fates of duplicated genes. Nat Rev Genet 3: 827-37
12) Hughes TA (2006) Regulation of gene expression by alternative untranslated regions. Trends Genet 22: 119-22
13) Oyama M, et al. (2004) Analysis of small human proteins reveals the translation of upstream open reading frames of mRNAs. Genome Res 14: 2048-52
14) 小林、樋口、青木、工藤(1995) 「三次元内部構造顕微鏡の開発」 精密工学会誌, 第61巻, 第1号, 100-106
15) 横田秀夫(2004)「生体を対象としたディジタイジングのための三次元内部構造顕微鏡の開発」 生体力学シミュレーション研究プロジェクト第一期成果報告会予稿
16) 小川、宮下、清水、杉山(2003) 「連続切片の自家蛍光観察によるダイズ種子の3次元内部構造」 日本食品科学工学会誌 Vol.50, No.5, 213-217
17) Hirai T, Yamada H, (2006) "Refraction contrast 11x-magnified X-ray imaging of large objects by MIRRORCLE-type table-top synchrotron." J Synchrotron Radiat. (Pt5):397-402