年度別活動報告
年度別活動報告書:2007年度
脊索動物と節足動物の共通祖先を理解する 2-1 オオヒメグモの体軸形成と尾葉形成の分子メカニズム
小田広樹(主任研究員) 秋山-小田康子(奨励研究員)
野田彰子(研究補助員) 春田知洋(大阪大学大学院生)
金山真紀(大阪大学大学院生)
はじめに
系統的に遠く離れていると考えられている2つの動物グループ、脊椎動物と昆虫において、相同な遺伝子が類似した発生現象に関わっている例が多数見つかっている1)。代表的な遺伝子としては、体の前後や背腹を決める遺伝子や眼の分化を制御する遺伝子が知られている。このような発生システムの類似を根拠として、今から6億年以上前にすでに脊椎動物と節足動物に共通な特徴をもつ複雑な形をした動物が誕生しており、その子孫として現在の多様な動物群が現れたと考えられるようになった。しかし、もしこの考えが正しいとすると、次に問題になるのはどのような変化がそれぞれの動物グループを誕生させたのかである。この変化を説明できなければ、動物の多様性の成り立ちを理解したとは言えない。とりわけ、無脊椎動物から脊椎動物が誕生した過程においてどのような変化が起こったかを調べることは私たちヒトの歴史をたどる意味を持つ。脊椎動物の個体発生において重要な役割を果たす脊索の起源は何か? 脊椎動物の体節は節足動物の体節と同じ起源を持つのか、それとも脊椎動物の系統で独自に進化してきたのか? これらの問題を解く鍵は、脊椎動物が誕生する以前の無脊椎動物の状態を如何に知るかにある。この目的を達成するためにこれまで私たちは、節足動物門の鋏角類に属するオオヒメグモ (Achaearanea tepidariorum) を新しいモデル動物として開発してきた。
私たちがオオヒメグモに注目する理由は主に以下の4つである。1) 系統的に見て昆虫と脊椎動物の間に位置すること。2)脊椎動物と同じように体軸を調節的に発生させること2)。3)実験を遂行する上で利便性があり、今後の技術開拓の可能性も十分にあること。4)微細形態が脊椎動物のものに酷似したタイトジャンクションを持っていること3)。これまでの胚発生の研究で私たちは、i) オオヒメグモではDppによる背側の誘導なしに腹側のパターン形成が進行しないこと、ii) ショウジョウバエの腹側のパターン形成がSogの活性を必要としないのに対して、オオヒメグモの腹側のパターン形成はSogに大きく依存していること4)、iii) 原口部から活性化されるDelta-Notchシグナルが尾部領域の形成に必須であること5)を示した。これらの発見は、ショウジョウバエとオオヒメグモの発生プログラムの違いを明らかにしただけでなく、クモと脊椎動物の胚発生の仕組みに注目すべき類似点があることを明らかにした6)。具体的には、クモの腹側正中線外胚葉の特異化の仕組みが脊椎動物の背側の正中線組織(脊索/神経底)の特異化の仕組みに類似していることを見出し、脊椎動物の脊索の起源を理解するためのひとつの糸口を提示した。ところが、私たちが共通起源をもつ組織であると考えているクモの腹側正中線外胚葉と脊椎動物の脊索は異なる胚葉(外胚葉 対 中胚葉)の組織であり、私たちの仮説は胚葉の進化に関する深刻な問題を抱えている。同じような胚葉の問題は体節形成についても言える。つまり、それは節足動物の体節形成が主に外胚葉で起こるのに対して、脊椎動物の体節形成は中胚葉だけで起こることである。それでも、私たちはこれらの問題を解消する手がかりが尾部の発生進化にあるかもしれないと考えている。その理由は、クモと脊椎動物の両者において尾部の発生は中胚葉の発生と密接に関連しており、かつ体節形成の場ともなっているからである。これらの仮説の検証を進めるために、私たちはオオヒメグモの体軸及び尾部の発生を制御する仕組みを詳細に解析している。
結果と考察
(1)尾葉に特異的に発現する遺伝子の探索
クモの胚帯の後端部は伸長しながら体節を形成している。この体節形成の場となっている領域は特徴的な形態を示し、尾葉と呼ばれる。私たちは尾葉形成に関わる遺伝子を網羅的に探索するために、尾葉形成期と胚帯初期の異なる2つのcDNAライブラリーを作製した。これらのcDNAライブラリーはいずれも均一化処理を施している。これらのcDNAライブラリーを元に独自にEST解析を行い、尾葉形成期のものから4865個、胚帯初期のものから3498個の5’末端配列を決定した。現在、これらのESTクローンと配列情報を利用して、以下に示す2つの方法で尾葉特異的に発現する遺伝子を探索している。
i) 合成オリゴヌクレオチドをプローブとしたマイクロアレイ解析
昨年度の報告書に記した通り、正常胚とデルタRNAi胚で発現量に差のある遺伝子の候補をマイクロアレイによって検出した。ポジティブとなったクローンのwhole-mount in situ による発現パターンの解析から、脊椎動物で知られているNotch-regulated ankyrin repeat protein (Nrarp)7) の相同遺伝子がクモ胚の予定尾葉領域とその後の尾葉で発現していることが分かった(図1)。Nrarpとデルタの転写産物の発現パターンは相補的であり、デルタ RNAi胚を用いた発現解析から、Deltaシグナルの下流でこの遺伝子の発現が起こっていることが示唆された。脊椎動物でも同じことが知られており、この遺伝子発現制御は脊椎動物とクモで保存されていることが考えられた。Nrarpのオルソログはショウジョウバエや他の昆虫のゲノムの中には見つからない。Nrarp遺伝子は昆虫へ向かった進化の過程でゲノムから欠失した可能性が高い。この点からも、クモは祖先的な形質を解析することのできるよいモデルであると言える。さらに、RNAiによるNrarpの機能抑制を試みた。しかし、その影響についてまだはっきりとした結論を得ていない。
デルタRNAi胚を用いたマイクロアレイ実験では、この実験手法がオオヒメグモの初期胚の遺伝子発現を比較するのに十分な検出感度を持っていることを示すことができた。そこで今年度は新たに、デルタRNAi胚よりも早くに予定尾葉領域で異常が生じるパッチトRNAi胚を用いてマイクロアレイ実験を行った。24,000種類のオリゴプローブ(40mer)をデザインし、in situ合成方式のマイクロアレイを作製した。胚盤期後期の正常胚と同じステージのパッチトRNAi胚からtotal RNAを精製し、現在解析中である。
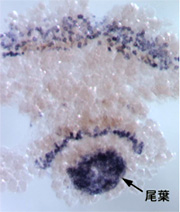 |
図1. オオヒメグモNrarp mRNAの尾葉での発現
ii) ホールマウントin situによる遺伝子発現パターンの網羅的解析
それぞれのESTクローンからDIG標識のRNAプローブを作製し、ハイスループットin situハイブリダイゼーションを実施している。各プローブに対して胚盤期と胚帯期の2つの胚を染色している。これまでに1056個のクローンの染色を完了した。尾葉に特異的な発現を示すもの、それ以外にも領域特異的な発現を示すものが得られている。
(2)オオヒメグモのヘッジホッグとパッチトは体軸形成を制御する
ヘッジホッグは分泌タンパク質をコードし、パッチトはその受容体をコードしている。これらの遺伝子は脊椎動物と無脊椎動物に共通して存在し、ショウジョウバエの体節や翅、脊椎動物の肢や神経のパターン形成に重要な役割を果たすことが知られている8)。私たちは昨年度までにRNAiによる機能解析によって、オオヒメグモのヘッジホッグとパッチトが体節形成よりも前に起こる体軸形成に必要とされることを示唆するデータを得ていた。今年度は、それらの遺伝子が働く仕組みを明らかにするために、RNAiによる表現型を詳細に解析した。 まず、リアルタイムPCRによって正常発生におけるヘッジホッグとパッチトの発現量の変化とRNAiによる遺伝子発現の抑制効果を調べた。その結果、最も初期の胚には母親由来のパッチト転写産物が存在するが、ヘッジホッグ転写産物は存在しないことが分かった。ヘッジホッグ転写産物は胞胚期に発現が始まり、その後胚盤が形成されるとともに発現量が上昇した。パッチトRNAiとヘッジホッグRNAiによってそれぞれの遺伝子の発現量が減少していることも確認した。得られている表現型が標的遺伝子の発現抑制によるものであると考えられた。
パッチトRNAi胚では、クムルスの分化に影響はないが、その胚盤の中心からの移動が再現性よく阻害された。同時に、その胚では胚盤の中心から広がるはずのデルタの発現やその後のコーダルの発現も見られなかった(図2)。クムルスが移動しなかったことと関連して、本来背側に誘導されるべき胚外領域が胚盤の中心領域(将来の尾葉になるべき領域)に誘導された。パッチトRNAi胚では、将来前方部に寄与する胚盤の縁側での遺伝子発現に異常は見られなかった。
それに対して、ヘッジホッグRNAi胚では胚盤の縁に発現するはずの前方部のマーカー分子の発現が見られず、胚盤の中心から広がるデルタやコーダルの発現が過剰に広がった(図2)。つまり、胚盤全体が尾部化した。ヘッジホッグRNAi胚でもクムルスの移動は起こった。しかし、背腹軸は発生しなかった。この異常は尾部化と関連しているものと推察された。
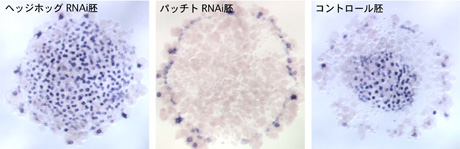 |
図2. ヘッジホッグ、パッチトRNAi胚におけるデルタの発現
(3)オオヒメグモの頭胸部におけるパターン形成の仕組みの解明
オオヒメグモの胚盤の中心領域と周縁領域は、将来それぞれ頭胸部と後体部になる。後体部になる中心領域は尾葉として発生し、後方へ向けて順次体節を形成していく。それに対して、頭胸部になる周縁領域はダイナミックな再配列運動を伴って前後に伸長し、比較的同調的に体節を形成する。細胞化した状態において、どのような仕組みで同調的に体節を形成するのか? 頭胸部と後体部で体節形成の仕組みにどのような共通点と相違点があるのか? これらの問題は、節足動物門における体節形成の進化を理解する上で重要な意味を持つ。これまでの観察では胚盤において将来の体節に対応する領域の細分化がすでに起こっているという証拠は得られていない。それでも、胚盤の縁の1から2列の細胞ではヘッジホッグ、オルソデンティクル、ハンチバック、デルタなどの転写因子やシグナル分子をコードする遺伝子が発現していることが分かっていたので、これらの遺伝子の機能解析が頭胸部における体節形成の仕組みを理解することへとつながるかもしれないと考えた。
前述のようにヘッジホッグのノックダウンは胚盤全体の尾部化を引き起こし、体節形成はほぼ完全に阻害された。このことからヘッジホッグは体節形成に必須の上流因子であることが示唆された。オルソデンティクルとハンチバックの胚盤の縁での発現は、ヘッジホッグRNAi胚において観察されなかったことから、これらの遺伝子の発現はヘッジホッグの下流で制御されていることが示唆された。そして、デルタRNAi胚の表現型の解析からオルソデンティクルとハンチバックの発現はヘッジホッグだけでなくデルタの支配も受けていることが分かった。次に、オルソデンティクルとハンチバックを別々にノックダウンすると、頭胸部の異なる領域が欠失した。さらに、胚盤の縁ではなくその近接した領域に発現するオッドペアードをノックダウンすると、オルソデンティクルRNAi胚で欠失した領域に含まれる2つの体節に異常が表れた。オッドペアードの胚盤周縁での発現はヘッジホッグを必要とするが、デルタは必要としなかった。これらの結果は、胚盤の縁の細胞が頭胸部のパターン形成に重要な役割を果たしていることを示すとともに、ヘッジホッグとデルタによる細胞間シグナルが複数の異なる転写因子の発現を差別的に制御することによって頭胸部に異なる領域を生み出していることを示した。オルソデンティクル、ハンチバック、オッドペアードはショウジョウバエでも前後パターンの形成に働いているが、ハエとクモの決定的な違いは、クモではそれらの転写因子の発現が細胞間シグナルによって支配されている点である。たとえ同じ節足動物門に属する動物であっても前後パターン形成の発生プログラムに大きな違いが存在することが明らかになった。
おわりに
これまでの研究でクモの体軸形成における細胞間シグナルの重要性が明らかになってきている。しかし、このクモの実験系において、ある細胞が発信するシグナルが周りの細胞にどのような影響力をもつのかはまだほとんど解析できていない。調節的発生の仕組みをより深く知るには、そのような解析を実現化する強制発現系の開発が不可欠である。また、脊椎動物と節足動物の進化的関係を発展的に議論するためには、ゲノム情報に基づく比較解析が必須である。蓄積したオオヒメグモの塩基配列を活用するためにも、今後バイオインフォマティクス的手法によって遺伝的変化を検出する試みを行っていく必要がある。
