年度別活動報告
年度別活動報告書:2014年度
脊索動物と節足動物の共通祖先を理解する 2−2 カドヘリンの構造と機能の解析
小田広樹(主任研究員) 秋山-小田康子(特別研究員)
佐々木瑞希(奨励研究員) 岩﨑佐和(奨励研究員)
野田彰子(研究補助員)
はじめに
多細胞動物は、細胞と細胞を連結する微細構造(ジャンクションと呼ぶ)を持ち、ジャンクションを巧みに操ることによって体の形を作り上げる。ジャンクションには微細形態と機能によって何種類かのタイプが知られており、その中でもアドヘレンスジャンクションは、多細胞動物で最も広い系統分布を示すジャンクションで、形態形成に最も密接に関わっていることが知られている8)。アドヘレンスジャンクションの主要な接着分子はクラシカルカドヘリン(以後、カドヘリンと呼ぶ)である。このカドヘリンは隣接した細胞に発現する同種のカドヘリンを認識し、結合する。上皮組織では、各細胞内で作用する張力がカドヘリンの細胞外領域での分子間結合を介して隣接細胞に伝達されるが、この力学的相互作用が上皮組織の形態形成運動を引き起こす主要因の一つとなっている9)10)。
細胞間で起こるこの同種カドヘリン間の結合は、細胞外カドヘリンドメイン(EC)と呼ばれる繰り返し構造を介して行われる。ところが、興味深いことに、形態形成運動に必要な力が作用するカドヘリン細胞外領域におけるECドメインの数やドメイン構成には、多細胞動物の系統間で多様性がある11)。例えば、昆虫類および鰓脚類は、7個のECを持ち上皮組織に局在するA1型カドヘリンと、17個のECを持ち神経組織に局在するA2型カドヘリンを持つ。ウニのカドヘリンは17個のEC、脊椎動物とホヤのカドヘリンは5個のECを持つ。カドヘリンの構造はどのように多様化してきたのか? その多様化の際、カドヘリンの機能や接着のメカニズムは変化したのか? さらに、そのようなジャンクションにおける変化は形態の進化に影響を与えなかったのか? 本研究では、これらの疑問に対する答えを探究している。
本年度私たちは新たに、オリンパスと共同でカドヘリンの分子構造を原子間力顕微鏡で観察する試みを始めた。この観察技術は、探針を走査することにより細胞の表面や分子の表面の凹凸を直接観察する技術である12)。この技術の利点は、タンパク質の結晶化を必要とせず、タンパク質が少量でも穏やかな条件下で精製できさえすれば比較的手軽に観察することができる点である。高分子タンパク質の全体的な構造を観ることができる点も利点である。私たちのこれまでの研究で、昆虫類と鰓脚類が持つA1型カドヘリンの接着機能にN末側の6個のECが主要な役割を果たしていることを明らかにしていたが、本年度、その領域のポリペプチドを精製し、原子間力顕微鏡での観察を始めた。
結果と考察
(1)昆虫型Eカドヘリンの細胞外ドメインの精製と原子間力顕微鏡による観察
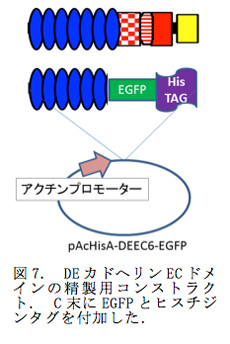
ショウジョウバエのN末の6個のECがどのような構造をしているかを原子間力顕微鏡で直接観察することを考え、そのECドメインの精製を行った。EC6のC末にEGFPをつなげ、さらにそのC末にHisタグを付加したタンパク精製用のプラスミドコンストラクト(DEEC6-EGFP)を作製した(図7)。このプラスミドを使って、DEEC6-EGFPを定常的に発現するショウジョウバエのS2細胞株を作製した。
オリンパスとの共同でその細胞の培養上清から抗Hisタグビーズを使用してDEEC6-EGFPを精製し、オリンパスが開発している原子間力顕微鏡でその分子の構造の観察を行った。現段階ではまだ明確な結論を得ていないが、カドヘリンの新しい構造が分かりつつある。現在、DEEC6-EGFPに加えて、EGFPを除いたコンストラクトやEC4までのコンストラクトを作製し、原子間力顕微鏡による分子構造の観察を行っている。
おわりに
2012年度の報告書の中で、昆虫型EカドヘリンではEC3からEC4までの領域に接着特異性を決める領域があることを示したが、原子間力顕微鏡による分子構造の直接観察により、その接着特異性を決める構造基盤を明らかにできる可能性がある。また、昆虫型Eカドヘリンに比べ、フナムシのクラシカルカドヘリンではECドメインがN末側に2つ多いドメイン構成を取っており、異なるカドヘリン間の比較解析を進めることによって、ドメイン構成の進化と接着を担う構造メカニズムの進化がどのような関係にあるかを理解することができるかもしれない。
参考文献
- 1) Akiyama-Oda, Y., Oda, H. (2006) Axis specification in the spider embryo: dpp is required for radial-to-bilateral symmetry transformation and sog for ventral patterning. Development 133, 2347-2357.
- 2) Akiyama-Oda, Y., Oda, H. (2010) Cell migration that orients the dorsoventral axis is coordinated with anteroposterior patterning mediated by Hedgehog signaling in the early spider embryo. Development 137, 1263-1273.
- 3) Driever, W., Nüsslein-Volhard, C. (1988) The bicoid protein determines position in the Drosophila embryo in a concentration-dependent manner. Cell 54, 95-104.
- 4) Kanayama, M. Akiyama-Oda, Y., Nishimura, O., Tarui, H. Agata, K., and Oda, H. (2011) Travelling and splitting of a wave of hedgehog expression involved in spider-head segmentation. Nature Communications 2, 500.
- 5) Fujimoto, K., Ishihara, S., Kaneko, K. (2008) Network Evolution of Body Plans. PLoS ONE 3, e2772.
- 6) オオヒメグモゲノムプロジェクトのホームページ(Human Genome Sequence Center, Baylor College of Medicine)
https://www.hgsc.bcm.edu/arthropods/common-house-spider-genome-project - 7) Holm, Å. (1952). Experimentelle Untersuchungen über die Entwicklung undEntwicklungsphysiologie des Spinnenembryos. Zool. BiDr Uppsala 29,293-424.
- 8) Harris, T. (2012) Adherens Junctions: from Molecular Mechanisms to Tissue Development and Disease, Subcellular Biochemistry 60, Springer Netherlands.
- 9) Rauzi, M., Verant, P., Lecui, T., Lenne, P.F. (2008) Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell Biol. 10, 1401-10.
- 10) Landsberg, K.P., Farhadifar, R., Ranft, J., Umetsu, D., Widmann, T.J., Bittig, T. Said, A., Jülicher, F., Dahmann, C. (2009) Increased cell bond tension governs cell sorting at the Drosophila anteroposterior compartment boundary. Curr. Biol. 19, 1950-1955.
- 11) Oda, H., Tagawa, K., Akiyama-Oda, Y. (2005) Diversification of epithelial adherens junctions with independent reductive changes in cadherin form: identification of potential molecular synapomorphies among bilaterians. Evol. Dev. 7, 376-389.
- 12) Suzuki,Y., Sakai, N., Yoshida, A., Uekusa, Y., Yagi, A., Imaoka, Y., Ito, S., Karaki, K. and Takeyasu, K. (2013) High-speed atomic force microscopy combined with inverted optical microscopy for studying cellular events. Sci Rep 3, 2131.
