年度別活動報告
年度別活動報告書:2013年度
脊索動物と節足動物の共通祖先を理解する 2−2 カドヘリンの構造と機能の解析
小田広樹(主任研究員 秋山-小田康子(特別研究員)
佐々木瑞希(奨励研究員) 野田彰子(研究補助員)
逸見なつき(大阪大学大学院生)
はじめに
多細胞動物は、細胞と細胞を連結する微細構造(ジャンクションと呼ぶ)を持ち、ジャンクションを巧みに操ることによって体の形を作り上げる。ジャンクションには微細形態と機能によって何種類かのタイプが知られており、その中でもアドヘレンスジャンクションは、多細胞動物で最も広い系統分布を示すジャンクションで、形態形成に最も密接に関わっていることが知られている8)。アドヘレンスジャンクションの主要な接着分子はクラシカルカドヘリン(以後、カドヘリンと呼ぶ)である。このカドヘリンは隣接した細胞に発現する同種のカドヘリンを認識し、結合する。上皮組織では、各細胞内で作用する張力がカドヘリンの細胞外領域での分子間結合を介して隣接細胞に伝達されるが、この力学的相互作用が上皮組織の形態形成運動を引き起こす主要因の一つとなっている7) 9)。
細胞間で起こるこの同種カドヘリン間の結合は、細胞外カドヘリンドメイン(EC)と呼ばれる繰り返し構造を介して行われる。ところが、興味深いことに、形態形成運動に必要な力が作用するカドヘリン細胞外領域におけるECドメインの数やドメイン構成には、多細胞動物の系統間で多様性がある。カドヘリンの構造はどのように多様化してきたのか? その多様化の際、カドヘリンの機能や接着の仕組みは変化したのか? さらに、そのようなジャンクションにおける変化は形態の進化に影響を与えなかったのか? 本研究では、これらの疑問に対する答えを探究しており、本年度私たちは、節足動物のゲノム解析を中心に解析を進めた。
動物間のアミノ酸配列比較解析により、カドヘリン分子には動物系統間で構造的多様性が存在することが知られている10) 11) 12)。例えば、昆虫類および鰓脚類は、7個のECを持ち上皮組織に局在するA1型カドヘリンと、17個のECを持ち神経組織に局在するA2型カドヘリンを持つ。ウニのカドヘリンは17個のEC、脊椎動物とホヤのカドヘリンは5個のECを持つ。私たちは多様化したカドヘリン分子の起源とその進化過程を追跡するため、節足動物を用いてカドヘリン分子のドメイン構成およびゲノムレベルでの遺伝子構造を比較することとした。
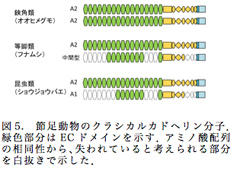
昆虫類および鰓脚類の上皮組織に存在するA1型カドヘリンは鋏角類ならびに等脚類では未だ知られていない。そこで私たちはオオヒメグモとフナムシにA1型カドヘリンが存在するか探索し、A1型カドヘリンの起源および進化の過程の中間型と思われる新たなカドヘリン分子を同定した。さらに、ゲノム解読がなされている動物の間でカドヘリン遺伝子のゲノム上の構造を比較することで、祖先的な構造からそれぞれの系統で多様化した過程を説明することができた。
結果と考察
(1)オオヒメグモとフナムシのクラシカルカドヘリン遺伝子の同定
ショウジョウバエをはじめとした昆虫類およびアルテミアなどの鰓脚類においては、7個のECを持つA1型カドヘリンと17個のECを持つA2型カドヘリンの2つのカドヘリンが存在することが知られている。一方、鋏角類であるオオヒメグモならびに等脚類であるフナムシにおいては17個のECを持つA2型の分子のみが報告されている9)。オオヒメグモやフナムシのA2型分子がA1型の機能を担っているのか、あるいはECの少ないA1型分子が存在するのかは不明である。
そこでオオヒメグモcDNAライブラリーより、さらなるカドヘリン分子の探索を行ったところ、これまで報告があったPtカドヘリン1とは異なるPtカドヘリン2を同定した。Ptカドヘリン2は1と同様17個のECを持つA2型の分子であった(図5)。また、次世代シーケンサーを用いたオオヒメグモゲノムからの探索により(2‐1)、クラシカルカドヘリン細胞内ドメインはこれら2種のものしか見出されず、オオヒメグモのカドヘリンは2つのA2型分子のみであると考えられた。
さらに、等脚類であるフナムシについて、次世代シーケンサーを用いてRNA-seq解析を行い、これよりクラシカルカドヘリン細胞内ドメインを持つ遺伝子を探索した。その結果、これまで報告されていたLeカドヘリン1の他に、もうひとつのカドヘリン分子Leカドヘリン2を同定した。Leカドヘリン1は17個のECを持つのに対し、Leカドヘリン2のECは9個であり、さらにラミニンGドメインやシステインリッチEGF様ドメインなど一部の領域が欠損した構造を有していた。この構造はA1型分子とA2型分子の中間の構造である可能性が考えられた(図5)。
オオヒメグモPt1およびPt2カドヘリン分子のmRNA発現部位を検討したところ、上皮組織にはPtカドヘリン2の発現が見られた。このことから、Ptカドヘリン2は昆虫類や鰓脚類のA1型カドヘリン分子と同様上皮組織で接着機能を有する可能性が示唆された。すなわち、節足動物の進化の過程で、上皮組織ではオオヒメグモのような多くのECドメインを持つ分子からフナムシのような中間型を経て昆虫類および鰓脚類に見られるA1型カドヘリン分子が生じたと考えられる。

(2)ゲノム比較によるクラシカルカドヘリンの祖先的遺伝子構造と多様化過程の推定
2つのオオヒメグモカドヘリンを同定し、さらにゲノム情報が得られたため(2-1)、Pt1およびPt2カドヘリン遺伝子のゲノム上の構造を調べた。いずれも35のエキソンからなり、エキソンとイントロンの境界は両分子においてほぼ一致していた。さらに、ゲノムが解読されている動物に関して、カドヘリン遺伝子のエキソン・イントロンの構造を調べたところ、オオヒメグモカドヘリンのイントロン挿入部位の多くが、他の門の動物においても保存されていた(図6)。このことから、オオヒメグモのカドヘリンはそれぞれの系統に保存された祖先的な形質を持つと考えられた。
さらに、節足動物のA1型、A2型カドヘリンの進化過程を知るため、節足動物のカドヘリンの間でエキソン・イントロンの構造を比較した。A2型カドヘリン遺伝子のイントロン挿入部位は多くの箇所でオオヒメグモのものと一致していた(図7)。さらに、ECの少ないA1型においてもアブラムシやミツバチにおいて複数の箇所で一致がみられた。一方、ショウジョウバエでは多くのイントロンが失われおり、祖先的な形質が少ないと考えられた。以上のことから、鋏角類のカドヘリン遺伝子の構造が祖先的であり、進化の過程において昆虫類のA2型のみならず、A1型もECの多い祖先的な分子から派生したと考えられた。

おわりに
今年度の研究により、オオヒメグモとフナムシのカドヘリンを同定し、これらが昆虫類や鰓脚類のA1型とは異なる構造のカドヘリン分子を有することが明らかになった。また、昆虫類A1型分子と同様に、A2型分子であるオオヒメグモPtカドヘリン2が上皮組織に局在していることが示された。このことから、昆虫類や鰓脚類のA1型カドヘリン分子の起源はオオヒメグモのA2型カドヘリンのように多くのECを持つ分子であり、これがフナムシLeカドヘリン2のような中間型を経てA1型が生じた可能性が示された。Leカドヘリン2のような構造を持つカドヘリン分子はこれまで報告されておらず、他の甲殻類も同様の分子を有するのかさらなる探索が必要である。
さらに、カドヘリン遺伝子のゲノム上の構造を調べることにより、カドヘリンの進化の過程を説明することができた。エキソン・イントロンの構造を比較することで、オオヒメグモの持つカドヘリン分子が他の多くの動物門に保存されている祖先的構造を有することが示された。今後は胚性 RNA干渉による機能阻害実験や培養細胞系を用いた接着試験によりオオヒメグモ上皮組織に発現するA2型カドヘリン分子の機能について検討する予定である。このA2型カドヘリン分子の機能が昆虫類のA1型と異なるのか、さらにカドヘリン分子構造の多様性が形態形成にどのような影響を及ぼしたのかを明らかにしたいと考えている。
引用文献
- 1) Akiyama-Oda, Y., Oda, H. (2006) Axis specification in the spider embryo: dpp is required for radial-to-bilateral symmetry transformation and sog for ventral patterning. Development 133, 2347-2357.
- 2) Akiyama-Oda, Y., Oda, H. (2010) Cell migration that orients the dorsoventral axis is coordinated with anteroposterior patterning mediated by Hedgehog signaling in the early spider embryo. Development 137, 1263-1273.
- 3) Driever, W., Nüsslein-Volhard, C. (1988) The bicoid protein determines position in the Drosophila embryo in a concentration-dependent manner. Cell 54, 95-104.
- 4) Fujimoto, K., Ishihara, S., Kaneko, K. (2008) Network Evolution of Body Plans. PLoS ONE 3, e2772.
- 5) Kanayama, M. Akiyama-Oda, Y., Nishimura, O., Tarui, H. Agata, K., and Oda, H. (2011) Travelling and splitting of a wave of hedgehog expression involved in spider-head segmentation. Nature Communications 2, 500.
- 6) Honda, H., Eguchi, G. (1980) How much does the cell boundary contract in a monolayered cell sheet? J. Theor. Biol. 84, 575-588.
- 7) Rauzi, M., Verant, P., Lecui, T., Lenne, P.F. (2008) Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell Biol. 10, 1401-10.
- 8) Harris, T. (2012) Adherens Junctions: from Molecular Mechanisms to Tissue Development and Disease, Subcellular Biochemistry 60, Springer Netherlands.
- 9) Landsberg, K.P., Farhadifar, R., Ranft, J., Umetsu, D., Widmann, T.J., Bittig, T. Said, A., Jülicher, F., Dahmann, C. (2009) Increased cell bond tension governs cell sorting at the Drosophila anteroposterior compartment boundary. Curr. Biol. 19, 1950-1955.
- 10) Oda, H., Tagawa, K., Akiyama-Oda, Y. (2005) Diversification of epithelial adherens junctions with independent reductive changes in cadherin form: identification of potential molecular synapomorphies among bilaterians. Evol. Dev. 7, 376-389.
- 11) Oda, H., and Takeichi, M. (2011) Structural and functional diversity of cadherin at the adherens junction. Journal of Cell Biology 193, 1137-1146.
- 12) Oda, H. (2012) Evolution of the Cadherin-Catenin Complex. In "Adherens Junctions: from Molecular Mechanisms to Tissue Development and Disease" edited by Harris, T., Subcellular Biochemistry 60, pp.9-35, Springer Netherlands.
