年度別活動報告
年度別活動報告書:2009年度
脊索動物と節足動物の共通祖先を理解する 2−1 オオヒメグモの胚発生を支配する分子メカニズムの解明
小田広樹(主任研究員) 秋山-小田康子(奨励研究員)
野田彰子(研究補助員)
春田知洋、金山真紀(大阪大学大学院生)
はじめに
多細胞動物は形態や発生様式に基づいて動物門と呼ばれる高次分類群に分類されているが、それらの分類は形態が変化してきた歴史を表すものではない。私たちヒトを含む脊椎動物は、無脊椎動物のホヤやナメクジウオとともに、より高次の分類群の脊索動物門にまとめられている。このグループに共通する重要な形態形質は脊索と呼ばれる体の中心を貫く組織である。一方、ハエやチョウなどの昆虫は、エビやクモなどともに節足動物門にまとめられている。このグループに共通する形態は節構造をもつ外骨格である。脊索動物の脊索も節足動物の外骨格も機能性の高い構造物であり、それぞれのグループの中では保守的に進化してきたようである。このような形態進化の保守的側面は形態に基づいて分類することを正当化するが、保守性を破るような歴史的大変化を見抜き、理解することを難しくしている。ところが、ゲノムに基づく比較研究にはこの困難を克服する可能性がある。形態はあくまでもゲノムを介し、発生プログラムとして次世代に継承される。ゲノムの情報がどのように進化し、その進化が形態の進化とどのような関係にあったかを理解する努力が、生物の歴史を偏見無く、客観的に理解するために求められる。
本研究はゲノムの進化と形態の進化の関係を分析し、普遍原理を明らかにすることを長期的な目標としている。そのために、脊索動物門と節足動物門を軸とした比較学を展開している。私たちの研究室はこれまでに節足動物門鋏角類に属するオオヒメグモ (Achaearanea tepidariorum) を新しいモデル生物として開拓してきたが、昨年度までの研究成果により私たちは、同じ節足動物門のハエとクモでは形態は類似していても、ゲノムに書き込まれている発生プログラムに注目すべき違いがあることを明らかにしている1)。とりわけ、体軸を作り出す仕組みについてはハエとクモで大きな違いがある。現在までに私たちが理解している範囲で言えば、その違いは主に3つある。ひとつは、前後軸に沿ったパターンの形成にハエでは転写因子ビコイドが中心的役割を果たすのに対して2)、クモでは細胞間のシグナルを担うヘッジホッグが中心的役割を果たすこと。ふたつめは、前後軸と背腹軸の直交化がハエでは卵母細胞の中の核が微小管に沿って移動し、ガーケンシグナルの位置を非対称化させることによって達成されるのに対して3)、クモでは細胞移動によってディーピーピーシグナルの位置を非対称化させることよって達成されること4)。3つめは、腹側のパターン形成において、ハエでは転写因子ドーサルが中心的な役割を果たすのに対して5)、クモではソグと呼ばれるディーピーピーシグナルの拮抗阻害因子が中心的な役割を果たすこと4)。これらの違いは同じ動物グループの中でも発生プログラムが大胆に進化しうることを示唆しているために、ゲノムに基づく比較研究の正当性を危うくしている。つまり、進化の過程で起こった変化があまりに激しいため、現存の動物種の比較だけでは過去の変化を追跡することが困難なのではないかという危惧である。しかし、節足動物門の外に眼を向けると、オオヒメグモからの知見には注目すべき点が多い。形態に基づく分類区分とは対照的に、分子的仕組みの比較ではクモがハエよりも脊椎動物に似ている点が見つかる1)。そのようなクモと脊椎動物の類似が祖先的状態を反映していると結論付けることは難しいが、確実に言えることは、形態の異なるグループの関係を理解するには、まず各グループ内での発生プログラムの違いをしっかりと把握しなければならないことである。
私たちはこのような長期的視点に立ち、オオヒメグモを節足動物門における非昆虫類のモデルとして研究を進めている。本年度は、昨年度までに行ってきたヘッジホッグシグナルや挿入型体節形成の解析に加え、解析技術の高度化を目指してマイクロインジェクション法の確立に取り組んだ。
結果と考察
(1)マイクロインジェクション(微量注入)法の確立
マイクロインジェクションは様々な物質(例えば、蛍光色素や合成mRNA)を胚の細胞に導入するための基本的技術である。この技術は応用範囲が広く、細胞系譜の解析や細胞運動や細胞増殖の追跡解析、遺伝子機能の解析などに有用である。しかしこれまで、蛍光標識したデキストラン(蛍光デキストラン)をオオヒメグモ胚にマイクロインジェクションしても非常に低い頻度でしか細胞内に導入することができなかった。本年度、オオヒメグモの卵割期のステージを厳密に定義し、注射するタイミングや部位をいろいろと変えて試行錯誤し、蛍光デキストランを細胞内に効率よく導入できる条件を再調査した。その結果、16核期から128核期の胚の周縁細胞質に注射をすると、30-40%程度の頻度で蛍光デキストランを細胞に導入できることが分かった。そして同時に、オオヒメグモでは16核期もしくはそれ以前に細胞化が完了していることも確認できた。さらに、蛍光デキストランといっしょに、核局在化シグナルを付加した緑色蛍光タンパク質(NLS-GFP)をコードするmRNAを胚に注射したところ、核に局在化したNLS-GFPの発現が観察された。この結果は、オオヒメグモ胚においてマイクロインジェクション法が外来遺伝子の強制発現実験に利用できることを示した。現在、マイクロインジェクションをさらに活用する方法を検討している。
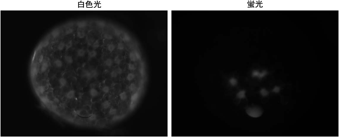
図1 オオヒメグモ初期胚への蛍光デキストランのマイクロインジェクション
(2)ヘッジホッグシグナルの下流で働く因子の探索
ショウジョウバエや多くの他の昆虫と異なり、オオヒメグモでは胞胚期以前に細胞化が完了する。このことは、オオヒメグモ胚では細胞化された環境で細胞間のコミュニケーションを介してパターン形成が行われていることを意味する。昨年度までの研究により、分泌タンパク質をコードするヘッジホッグ遺伝子が初期胚において非対称に発現し始め、胚のパターンを作り出すために中心的な役割を果たすことが示唆された。そこで、ヘッジホッグシグナルがどのような仕組みでパターン形成に貢献するのかを調べるために、マイクロアレイを用いてヘッジホッグシグナルの下流で働く因子を網羅的に探索した。
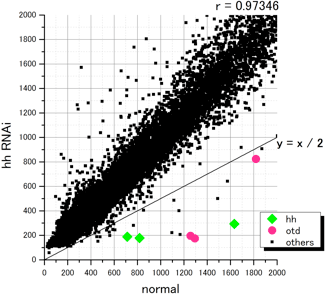
昨年度に行ったマイクロアレイ解析と同様に、これまでに蓄積したオオヒメグモの配列情報を用いて24,000個のオリゴDNAプローブ(40mer)をデザインし、in situ合成方式のマイクロアレイを作製した。そして、[胚盤期後期の正常胚]と[同じステージのヘッジホッグRNAi胚]からトータルRNAを精製し、競合ハイブリダイゼーションによる解析によって両者の間の遺伝子発現の比較を行った(図2)。シグナルの蛍光強度の比率[ヘッジホッグRNAi胚]/[正常胚]が0.5以下の値を示した30個のスポットを“ポジティブ”と判定した。重複もあったので、これらの30個のスポットに対応する遺伝子は最大でも19種類であった。その中にはヘッジホッグそのものや、パッチト、オルソデンティクルなどの、解析前からヘッジホッグの下流因子であることを把握していた遺伝子も含まれていた(図2)。このことは、マイクロアレイ解析が期待通りの精度で行われたことを示唆した。今後は、候補となった遺伝子の発現と機能の解析を行う予定である。
|
|
図2 マイクロアレイを用いた、ヘッジホッグシグナルの支配を受ける遺伝子の探索
マイクロアレイの各スポットについて[正常胚(normal)]と[ヘッジホッグRNAi胚(hh RNAi)]の蛍光強度をプロットした.ヘッジホッグ(hh)及びオルソデンティクル(otd)のスポットは◆と●で示している
(3)尾葉形成に関わる遺伝子の探索
クモ胚の後端部は伸長しながらひとつひとつ順番に繰り返し構造を生み出す。この後端領域は尾葉と呼ばれ、初期胚の原口を取り囲む領域から形成される。尾葉に相当する組織はショウジョウバエには存在せず、その発生を支配する分子メカニズムはほとんど分かっていない。ヘッジホッグの受容体であり、ヘッジホッグシグナルを負に制御するタンパク質パッチトは、原口周辺において尾葉の運命を特異化するために必要不可欠である。原口から陥入したCM細胞はディピーピーシグナルの発信源として働き、背側領域の誘導に重要な役割を果たす。昨年度、尾葉形成に関わる遺伝子を探索する目的でマイクロアレイ解析を行い、[胚盤期後期の正常胚]と[同じステージのパッチト、ディピーピー二重RNAi胚]の間で遺伝子発現を比較した。さらに、in situハイブリダイゼーションと遺伝子機能抑制実験を組み合わせて解析を行った結果、尾葉形成に必要とされる遺伝子としてAt_eW_020_B15を特定した。今後は、この遺伝子を中心に解析を進め、クモの尾葉形成の仕組みを明らかにしたいと考えている。
(4)背腹軸の向きを決める細胞運動におけるヘッジホッグシグナルの役割の解明
ヘッジホッグの受容体であるパッチトの発現をRNAiによって抑制すると、ディピーピーを発現するCM 細胞の、原口からの移動が阻害される。その結果、パッチトRNAi胚では背側領域が原口周辺に誘導され、背腹軸と前後軸が同一の向きにできてしまう。本年度、この背腹軸の向きを決める細胞運動を制御する仕組みを明らかにするために、ヘッジホッグシグナル経路を構成する他の因子について詳しく調べた。ヘッジホッグシグナルを細胞内に伝達する役割をもつ膜タンパク質にスムースンドが知られているが、RNAiによる解析から、スムースンドの機能抑制もCM細胞の移動に影響を与えることが明らかになった(図3)。原口領域からの細胞移動が完全に阻止されるケース、移動の開始が遅れるケース、CM細胞が胚盤の周縁部で止まらなくなるケースがあった。胚盤における遺伝子発現の解析では、ヘッジホッグの発現領域から最も離れた原口周辺を含めた胚盤全体でCM細胞の移動開始以前にヘッジホッグシグナルが伝達されていることが示唆された。その初期のシグナルは尾部への分化を抑制し、続いてパッチトによる負の制御がその分化抑制を原口領域から胚盤周縁に向けてダイナミックに解除する役割を果たすことが考えられた。この分化抑制の解除とCM細胞の移動は時空間的に近いところで起こっているようであった。まとめると、オオヒメグモではヘッジホッグシグナルによって胚の前後パターンが形成されており、このパターン形成と背腹軸の向きを決める細胞運動が一体的に制御されていることが示唆された。今回の発見をもとに私たちは、CM細胞がヘッジホッグのシグナル回路が生み出す位置価のダイナミックな変化に反応することで、移動開始のタイミングや移動の向きが決められている可能性をモデルで示した。しかし、位置価の分子的実体については全く不明である。今後は、CM細胞の移動に関わる遺伝子の探索を進めることに加えて、マイクロインジェクションなどを活用した実験によってモデルを検証していく予定である。
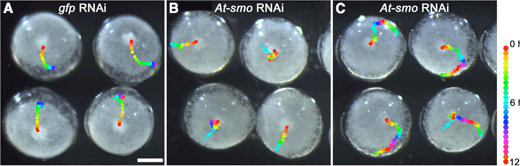 |
図3 スムースンドRNAi胚における細胞移動の異常
(A)コントロール胚.(B, C)スムースンドRNAi胚(シビアな表現型[B]とマイルドな表現型[C])CM細胞の位置を30分ごとに印している
(5)オオヒメグモの頭部領域における体節形成
ヘッジホッグの発現を指標としてオオヒメグモ胚の体節形成過程を解析したところ、頭部領域、胸部領域、後体部領域で体節形成の仕組みに違いがあることが示唆された。(3)で述べたように、後体部領域の体節は胚盤の中心領域から生じた尾葉が後方へ向けて成長するとともに順次形成される。一方、胸部領域の体節(歩脚に対応)は胚盤の中緯度領域から比較的同調的に形成され、頭部領域の体節は胚盤の周縁領域から前方に向けて成長しながら段階的に体節(鋏角、触肢に対応)が形成されているようであった。今年度新たにマイクロンジェクションによる細胞標識ができるようになったことで、胚盤内の細胞の位置とその後の胚帯内での細胞の位置の関係を明確に示すデータを出すことができるようになった。さらに、蛍光タンパク質を発現させて細胞の動きをライブで観察することもできるようになった。これまでの観察から(まだ十分とは言えないが)、胚盤の周縁領域に由来する胚帯の予定頭部領域では細胞分裂と細胞の割り込み運動(インターカレーション)が上皮細胞層の前後方向への伸長に貢献しており、その細胞層の中でヘッジホッグの発現が1つのストライプから二段階の分割を経て3つのストライプに変化していることが考えられた。昨年度の解析では、Znフィンガー型の転写因子をコードしているオッドペアード遺伝子に対するRNAiによって頭部領域のヘッジホッグのストライプが分割されなくなることを発見していたが、今年度、その遺伝子に由来する重複しない別の二本鎖RNAを用いて同様の表現型を得ることができた。それにより、オッドペアード遺伝子の機能と頭部領域の体節形成の関係が強固に示された。
本研究課題は(2)の研究課題とも密接に関連している。オオヒメグモの頭部領域における体節形成の解析を進めることによって、ヘッジホッグシグナルがどのような仕組みでパターンを生み出すかを解明できると同時に、昆虫における多核性胞胚の環境を前提とする体節形成の仕組みとの違いを明確にすることができると考えている。
おわりに
本年度は、オオヒメグモ胚でマイクロインジェクションができるようになり、技術面において新たな可能性が見えてきた。遺伝子の過剰発現や局所的な遺伝子機能の抑制、細胞の分裂や運動のライブイメージングなど様々な応用がありうる。今後オオヒメグモが新しいモデル生物として受け入れられるためには、オオヒメグモ胚でどんな解析をできるかのか、そして、どんな発見をできるのかが問われている。オオヒメグモのゲノムに真正面から向き合い、動物間の共通点を理解しながら最終的には動物間の本質的な違い(動物グループ間で起こった過去の変化)を解明したいと考えている。