年度別活動報告
年度別活動報告書:2009年度
脊索動物と節足動物の共通祖先を理解する 2−2 カドヘリンの構造と機能の解析
小田広樹(主任研究員) 秋山-小田康子(奨励研究員)
野田彰子(研究補助員)
春田知洋、金山真紀(大阪大学大学院生)
はじめに
多細胞動物は、細胞を連結する微細構造を持ち、その構造を巧みに操ることによって体の形を作り上げる。細胞間結合構造(ジャンクション)には何種類かのタイプが知られているが、その中でもアドヘレンスジャンクションは多細胞動物に最も普遍的に見られるジャンクションで、形態形成に最も密接に関わっていることが分かっている13)。アドヘレンスジャンクションの主要な接着分子はクラシックカドヘリン(以後、カドヘリンと呼ぶ)である。このカドヘリンは隣接の細胞に発現する同種のカドヘリンを認識し、それと結合する。私たちはこれまでの研究で、カドヘリンの細胞外領域のドメイン構成に左右相称動物の間で多様性があること、そして、その構造的多様性がヒトデやクモで共通に見られる状態からの独立的な短縮化で説明できることを見いだした14)。短縮化されたあるひとつの状態(昆虫型)は、ハエ、コオロギ、トビムシ、アルテミアで見られ、それとは別の状態(脊椎型)が脊椎動物とホヤで、そして、さらに別の状態(頭索型)がナメクジウオで見られる。それぞれの状態は進化的に安定であるが、動物の初期進化では大きな変化があったと考えられる。私たちは、そのようなカドヘリンの構造変化が分子の機能や能力にどのような変化をもたらしたのか、そして、それによって細胞の性質にどのような影響があったのかを実験によって検証したいと考えている。
そこで私たちは、ジョウジョウバエの上皮カドヘリン(DEカドヘリン)の構造を一つのモデルとして、カドヘリンの構造と機能の関係を、カドヘリンの突然変異体(ショットガン、shg)の表現型をレスキューする実験によって分析した。DEカドヘリンの細胞外領域は7回のカドヘリン特有のドメイン(EC1-7と呼ぶ)と、無脊索動物のカドヘリンに広く保存されているが、脊椎動物のカドヘリンには存在しない領域(PCCDと呼ぶ)からなる。PCCDの機能を理解することは、脊椎動物に向かった進化において細胞間接着の制御メカニズムがどのような変更を受けたのかを理解することにつながる。昨年度までの解析により、EC7とPCCDを欠く分子(DEΔPと命名[DEEC6から改名])が正常分子と同じように強い接着活性をもち、上皮細胞におけるアドヘレンスジャンクションの形成と維持だけでなく、カドヘリンに依存する多くの発生現象において十分な機能を果たすことを明らかにした8)。この発見は、多細胞動物が上皮構造を作れなくなることなく、カドヘリンの構造が一回の変化で短縮型に大きく変化しうることを説明する。しかしながら、私たちの実験結果はもう少し複雑である。DEΔPは生体内の多くの現象で十分な機能を果たすことができたにもかかわらず、予定中胚葉細胞で構成される上皮シートの折れ曲がり運動において十分な機能を果たすことができなかった8)。DEΔPで欠失している領域が上皮細胞の上端部を収縮させる現象(アピカル収縮と呼ぶ)に関わっている可能性が考えられた。本年度この問題をさらに掘り下げて研究するために、EC7を含めすべてのECを保持し、PCCDだけを欠く分子(DEΔPCCDと命名)を作製し、その性質をDEカドヘリンやDEΔPと比較し、分析した。
結果と考察
本来のDEカドヘリンをDEΔPCCDに置き換えた胚の作製
培養細胞を用いた細胞集合実験において、DEΔPCCDはホモフィリックな接着活性を示さなかったが、正常なDEカドヘリンにヘテロに結合する活性をもつことが示された。次に、DEΔPCCDを胚の上皮細胞に発現させたところ、正常にアドヘレンスジャンクションに局在することが示された。shgの接合体ホモ胚を用いたレスキュー実験では、気管の異常や腹側上皮の異常をレスキューできなかったことから、DEΔPCCDは生体内でも十分な接着活性を持たないことが考えられた。DEΔPCCDとは対照的に、EC7を持たないDEΔPが正常に近い接着活性を保持していることを考えると、EC7は接着に対して負の影響を及ぼしているようであるが、正常分子においてはその負の影響はPCCDによって打ち消されていることになる。
細胞生殖系列の細胞にshgヌルの変異を導入すると、卵形成に異常が生じる。主な異常は卵母細胞の卵室内での位置が乱れることと、ボーダー細胞の移動が乱れることである。これら2つの異常はDEΔPをユビキチンプロモーターの制御下でユビキタスに発現させるとレスキューされる。このレスキュー実験をDEΔPの代わりにDEΔPCCDを用いて行うと、後者の異常はレスキューされたが、前者の異常はレスキューされなかった。それでも、実験の規模を上げたところ、非常に低い頻度ではあったが、shgホモの生殖細胞に由来する胚を得ることができた。つまり、母性由来と接合体由来のすべてのDEカドヘリンがDEΔPCCDに置き換わった胚(DEΔPCCD胚と呼ぶ)を得た。
DEΔPCCD胚における形態形成の異常
DEΔPCCD胚ではDEΔP胚と同じようにほぼ正常に細胞化が行われ、胞胚上皮が形成された。しかし、その後の胚発生において、DEΔPCCD胚はDEΔP胚よりも激しい異常を示した。DEΔPCCD胚では予定中胚葉細胞のアピカル収縮が不完全にしか進行せず、胚帯の伸長が大きく阻害され、外胚葉上皮に正常では見られない多数の皺が形成された。それにも関わらず、DEΔPCCDタンパク質はアドヘレンスジャンクションのあるべき領域にしっかりと局在しており、上皮のシート状の構造は比較的正常に維持されていた。細胞集合実験でDEΔPCCDがホモフィリックな接着活性を示さなかったことを考えると、これらの結果は意外であった。生体内でDEΔPCCDが接着活性を残存させている可能性や、DEカドヘリンを介した接着の欠如を相補する接着分子が上皮細胞に存在している可能性が考えられた。
中胚葉のアピカル収縮においてDEカドヘリンが関わる分子メカニズムを解明するために、DEΔPCCD胚におけるアピカル収縮の異常をさらに詳しく解析した。これまでの観察では、アピカル収縮すべき細胞においてDEΔPCCDタンパク質はほぼ正常に接着面のアピカル端に局在するにもかかわらず、アピカル皮質へのミオシンの局在化がほとんど起こっていないことが分かった。このミオシンのアピカル皮質への局在化は、DEΔP胚では正常胚と同じように起こる8。DEカドヘリンの細胞外構造の改変がなぜミオシンの局在に影響を与えたのか? この問題を解明することは極めて重要であるが、これに関するデータは得られていない。他の研究では、機械的シグナルがミオシンの局在化を誘導することが指摘されている9)。そのような機械的シグナルの伝達にDEカドヘリンが直接関与する可能性もあるので、この可能性を検討することも含めて解析を進めていきたい。
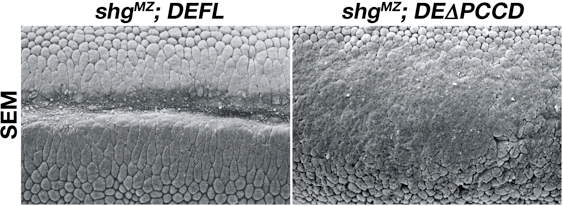 |
図3 本来のDEカドヘリンをDEΔPCCDに完全に置き換えた胚の表現型
(左)正常胚.(右)DEΔPCCD胚.
おわりに
DEカドヘリンの突然変異体をDEΔPやDEΔPCCDなどの改変分子でレスキューする実験によって、DEカドヘリンの細胞外構造の各部分が果たす機能についてある程度のデータが得られてきた。しかし、形態形成運動に関わるDEカドヘリンの構造的仕組みを解明するには依然としてデータが不足している。私たちが注目している、無脊索動物に特有の構造PCCDはDEカドヘリンの膜近傍領域にある。カドヘリン分子内での位置を考えると、PCCDの機能が膜遠位部でなされる分子間トランス結合の補強やジャンクションの硬性や収縮性、形質膜との連係などと結びつけられる可能性を秘めている。今後これらの可能性を検討していくためには、時空間的に高い解像度の、定量的な観察が必要である。さらには、コンピュータシミュレーションを用いた動力学的な分析も重要になると考えている。
参考文献
1) Oda, H. and Akiyama-Oda, Y. (2008). Differing strategies for forming the arthropod body plan: lessons from Dpp, Sog and Delta in the fly Drosophila and spider Achaearanea. Dev Growth Differ 50, 203-214.
2) Driever, W and Nusslein-Volhard, C. (1988). A gradient of bicoid protein in Drosophila embryos. Cell 54, 83-93.
3) Roth, S, Neuman-Silberberg, FS, Barcelo, G and Schupbach, T. (1995). cornichon and the EGF receptor signaling process are necessary for both anterior-posterior and dorsal-ventral pattern formation in Drosophila. Cell 81, 967-78.
4) Akiyama-Oda, Y. and Oda, H. (2006) Axis specification of the spider embryo: dpp is required for radial-to-axial symmetry transformation and sog for ventral patterning. Development 133, 2347-2357.
5) Roth, S, Stein, D and Nusslein-Volhard, C. (1989). A gradient of nuclear localization of the dorsal protein determines dorsoventral pattern in the Drosophila embryo. Cell 59, 1189-202.
6) Gumbiner, B. M. (2005). Regulation of cadherin-mediated adhesion in morphogenesis. Nat Rev Mol Cell Biol 6, 622-634.
7) Oda, H., Tagawa, K. and Akiyama-Oda, Y. (2005) Diversification of epithelial adherens junctions with independent reductive changes in cadherin form: identification of potential molecular synapomorphies among bilaterians. Evol. Dev. 7, 376-389.
8) Haruta, T., Warrior, R., Yonemura, S. and Oda, H. (2010) The proximal half of the Drosophila E-cadherin extracellular region is dispensable for many cadherin-dependent events but required for ventral furrow formation. Genes Cells 10 (in press).
9) Pouille, PA, Ahmadi, P, Brunet, AC and Farge, E. (2009) Mechanical signals trigger Myosin II redistribution and mesoderm invagination in Drosophila embryos. Sci Signal 2, ra16.
