年度別活動報告
年度別活動報告書:2008年度
脊索動物と節足動物の共通祖先を理解する 2−2 カドヘリンの構造と機能の解析
小田広樹(主任研究員) 秋山-小田康子(奨励研究員)
野田彰子(研究補助員)
春田知洋、金山真紀(大阪大学大学院生)
はじめに
多細胞動物は、細胞を連結する微細構造を持ち、その構造を巧みに操ることによって体の形を作り上げる。細胞間結合構造(ジャンクション)には何種類かのタイプが知られているが、その中でもアドヘレンスジャンクションは多細胞動物に最も普遍的に見られるジャンクションで、形態形成に最も密接に関わっていることが分かっている13)。アドヘレンスジャンクションの主要な接着分子はクラシックカドヘリン(以後、カドヘリンと呼ぶ)である。このカドヘリンは隣接の細胞に発現する同種のカドヘリンを認識し、それと結合する。私たちはこれまでの研究で、カドヘリンの細胞外領域のドメイン構成に左右相称動物の間で多様性があること、そして、その構造的多様性がヒトデやクモで共通に見られる状態からの独立的な短縮化で説明できることを見いだした14)。短縮化されたあるひとつの状態(昆虫型)は、ハエ、コオロギ、トビムシ、アルテミアで見られ、それとは別の状態(脊椎型)が脊椎動物とホヤで、そして、さらに別の状態(頭索型)がナメクジウオで見られる。それぞれの状態は進化的に安定であるが、動物の初期進化では大きな変化があったと考えられる。私たちは、そのようなカドヘリンの構造変化が分子の機能にどのような変化をもたらしたのか、そして、それによって細胞の能力や性質にどのような影響があったのかを実験によって検証したいと考えている。
そこで私たちは、ジョウジョウバエの上皮カドヘリン(DEカドヘリン)の構造を一つのモデルとして、カドヘリンの構造と機能の関係を、カドヘリンの突然変異体の表現型をレスキューする実験によって分析した。昨年度までの実験で、無脊索動物のカドヘリンに広く保存されているが、脊椎動物のカドヘリンには存在しない領域を大きく欠く変異型カドヘリン分子(私たちがDEEC6と命名した分子)が、培養細胞において正常分子と同程度の接着活性を持つこと、そして、その分子がアドヘレンスジャンクションの形成と維持や生体内で起こる多くの発生事象において十分な機能を果たせることを明らかにした。本年度は、正常分子をDEEC6で完全に置き換えた胚を作製することによって、その改変カドヘリン分子が正常分子と比べて果たすことができない機能が存在するかを検討した。
結果と考察
本来のDEカドヘリンをDEEC6に完全に置き換えた胚の作製
DEEC6がユビキチンプロモーターの制御下でユビキタスに発現している状態でshgヌルの生殖細胞クローンをもつ雌個体を作ったところ、正常な卵形成が行われた。さらに、shgヌル変異をもつ雄と交配させることによって、母親と接合体に由来するすべてのDEカドヘリンをDEEC6に置き換えた胚を得ることができた(以後、DEEC6への置換胚と呼ぶ)。このDEEC6への置換胚では正常に胞胚の上皮層が形成され、それ以後の外胚葉性上皮も胚帯退縮開始期までほぼ正常にふるまった。透過型電子顕微鏡による観察でも、上皮細胞においてアドヘレンスジャンクションが正常に形成され、維持されていることが確認された。DEEC6では細胞外領域の膜近位部を大きく欠いているが、アドヘレンスジャンクションにおける向かい合う細胞膜間の距離に関して正常胚とDEEC6への置換胚との間に違いは見られなかった。これらの結果は、DEEC6が本来のDEカドヘリンが果たすべき機能の多くを代替して果たすことができることを示唆した。
DEEC6への置換における上皮シート折れ曲がり運動の異常
DEEC6への置換胚の解析によってDEEC6が外胚葉性の上皮で十分に機能できることが示されたが、DEEC6への置換胚では多くの個体で中胚葉の陥入に異常が生じていた(図3)。正常であれば胚の左右両側から来る腹側正中線細胞が腹側を閉鎖するはずであるが、対応する時期にDEEC6への置換胚では腹側性正中線細胞が左右に離れたままになっていた。そこで、この異常の原因を突き止めるためにDEEC6に融合させているクラゲの緑色蛍光タンパク質(GFP)の蛍光をタイムラプス観察して、異常が生じるタイミングを調べた。その結果、多くのDEEC6への置換胚で中胚葉陥入の最初に起こるはずの溝形成が起こっていないことが分かった。さらに詳しく観察したところ、腹側の細胞の多くは正常胚と同じようにアピカル面の収縮を行ったが、正常胚と異なって、その収縮したアピカル面は上皮表面から速やかに消えてしまった。このアピカル面の消失に伴ってジャンクションのネットワークの崩壊が引き起こされている様子も観察された。それに対して、正常胚では個々の細胞のアピカル面は溝が形成されてその溝が深くなるまで上皮表面に保持された。これらの結果は、上皮シートの折れ曲がり運動においてDEカドヘリンがその細胞外領域の膜近位部を介して細胞のアピカル面を安定化していることを示唆した。この仕組みは上皮シートの折り曲げに必要な収縮力の伝達に貢献していると考えられる。
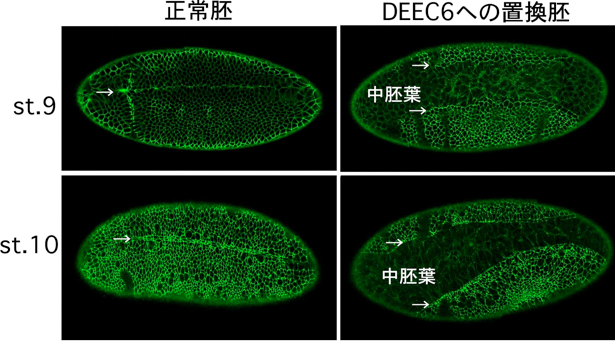 |
図3 本来のDEカドヘリンをDEEC6に完全に置き換えた胚の表現型
(左)正常胚.(右)DEEC6への置換胚. 中胚葉の陥入ができていない。矢印は腹側正中線細胞
おわりに
DEEC6を正常分子と置き換える解析によってDEカドヘリン分子の働きが具体的に明らかになってきた。カドヘリンは接着分子として理解されているが、単に細胞間の接着を担うだけでなく、同時に細胞のアピカル面の保持にも貢献してるようだ。DEEC6で欠いている部分は無脊索動物のカドヘリンに共通に存在するが、脊椎動物のカドヘリンには存在しないドメインを含む。脊椎動物ではそれらのドメインを進化の過程で欠失したと考えられるが、私たちのDEEC6に関する実験結果は、形態形成において上皮のアピカル面を制御する仕組みが脊椎動物に向かった進化で大きく変化した可能性を意味しているのかもしれない。この可能性をさらに実験的に検証するために、今後もカドヘリンの構造と機能の解析を進めていきたい。
参考文献
1) Carroll, S. B., Grenier, J. K., and Weatherbee, S. D. (2001) From DNA to diversity. Blackwell Science.
2) Holm, A. (1952) Experimentelle Untersuchungen uber die Entwicklung und Entwicklungsphysiologie des Spinnenembryos. Zool. BiDr Uppsala 29, 293-424.
3) Oda, H. and Akiyama-Oda, Y. (2008). Differing strategies for forming the arthropod body plan: lessons from Dpp, Sog and Delta in the fly Drosophila and spider Achaearanea. Dev Growth Differ 50, 203-214
4) Lane, N. J. (2001) Tight junctions in invertebrates. In: M. Cereijido and J. Anderson (eds.) Tight junctions (second edition), CRC Press LLC, Boca Raton, pp.39-59.
5) Akiyama-Oda, Y. and Oda, H. (2006) Axis specification of the spider embryo: dpp is required for radial-to-axial symmetry transformation and sog for ventral patterning. Development 133, 2347-2357.
6) Oda, H., Nishimura, O., Hirao, Y., Tarui, H., Agata, K. and Akiyama-Oda, Y. (2007) Progressive activation of Delta-Notch signaling from around the blastopore is required to set up a functional caudal lobe in the spider Achaearanea tepidariorum. Development134, 2195-2205.
7) McMahon, A.P., Ingham, P.W. and Tabin C. (2003) Developmental roles and clinical significance of Hedgehog signaling. Curr. Top. Dev. Biol. 53, 1-114.
8) Hooper, J. E. and Scott, M. P. (2005). Communicating with Hedgehogs. Nat Rev Mol Cell Biol 6, 306-317.
9) Ingham, P. W. and Placzek, M. (2006). Orchestrating ontogenesis: variations on a theme by sonic hedgehog. Nat Rev Genet 7, 841-850.
10) Varjosalo, M., Li, S. P. and Taipale, J. (2006). Divergence of hedgehog signal transduction mechanism between Drosophila and mammals. Dev Cell 10, 177-186.
11) Svard, J., Heby-Henricson, K., Henricson, K. H., Persson-Lek, M., Rozell, B., Lauth, M., Bergstr?m, A., Ericson, J., Toftg?rd, R. and Teglund, S. (2006). Genetic elimination of Suppressor of fused reveals an essential repressor function in the mammalian Hedgehog signaling pathway. Dev Cell 10, 187-197.
12) Preat, T. (1992). Characterization of Suppressor of fused, a complete suppressor of the fused segment polarity gene of Drosophila melanogaster. Genetics 132, 725-736.
13) Gumbiner, B. M. (2005). Regulation of cadherin-mediated adhesion in morphogenesis. Nat Rev Mol Cell Biol 6, 622-634.
14) Oda, H., Tagawa, K. and Akiyama-Oda, Y. (2005) Diversification of epithelial adherens junctions with independent reductive changes in cadherin form: identification of potential molecular synapomorphies among bilaterians. Evol. Dev. 7, 376-389.
