年度別活動報告
年度別活動報告書:2014年度
アゲハチョウの食草選択と進化
尾崎 克久(研究員) 吉澤 靖貴(奨励研究員)
廣嵜 由利恵(研究補助員)
はじめに
動物が外界に存在する化合物を認識することを「化学感覚」と呼ぶが、化学感覚は味覚と嗅覚に大別される。陸棲生物においては、水溶性・脂溶性の不揮発性化合物を感覚器官が接触して認識するものを味覚、揮発性化合物を非接触的に認識するものを嗅覚と呼ぶ。化学感覚は生物の生存にとって不可欠な機能であり、寄主選択・配偶行動・集団生活の維持・社会性の構築など、生存上の様々な役割を担っている。寄主選択に関わる化学受容の仕組みに変化が生じた場合、それまでとは異なる空間を生息の場として利用する集団が現れることで棲み分けが起こり、棲み分けが何世代にもわたって繰り返されることによって変化が蓄積し、やがて種分化へとつながると考えられている。このような変化は、進化の歴史を物語る証拠としてゲノムに刻まれる。動物と環境との関わりにおいて中心的な機能である味覚や嗅覚といった化学受容に関わる分子機構の解明は、多様化・種分化・環境への適応の仕組みを解明するために、最も有力な手がかりになると考えられる。
昆虫は地球上で最も多様化した生物群で、現時点で学名が付けられている全生物の過半数を占める。その中でも半数以上が植食性であり、昆虫と植物の関わり合いが多様性を生み出す主な要因のひとつである。中でも鱗翅目昆虫(チョウとガ)は、被子植物の誕生後に登場した新しいグループであると考えられており、99%以上が植食性で、その多くが特定の範囲の植物のみを宿主として利用する。アゲハチョウの仲間は、他の多くの鱗翅目昆虫と同様に、特定の植物のみを利用する範囲の狭い寄主選択をしており、寄主選択とアゲハチョウ科の進化には相関関係が認められる1。卵から孵化したばかりのアゲハチョウの幼虫は、体が小さく移動能力が低いため、広い環境中を歩き回って自力で餌を探索することは困難である。そのため、飛ぶことができ移動能力の高いメス成虫による正確な植物種の識別と産卵場所の選択は、次世代の生存に決定的な影響を与えることになる。メス成虫は産卵の直前に前脚で植物に触れることで、前脚ふ節にある化学感覚子を通じて植物に含有する化合物を感じ取り、その組み合わせによって産卵行動が引き起こされる。ナミアゲハ(Papilio xuthus)では、主な食草であるウンシュウミカンの葉から産卵刺激物質として10種類の化合物が同定されている2。他にも数種のアゲハ類で産卵刺激物質が明らかにされており、これら化合物の構造について比較すると類似性が認められる。このことから、植物の系統的近縁性とは無関係に、植物に含まれている化合物の類似性が寄主転換の可能性を支え、食性の進化を可能にしたのではないかと考えられている3。これまでに報告されている産卵刺激物質は全て不揮発性で、前脚ふ節で接触して感じていることから、アゲハチョウは前脚で「味」として認識していると考えられている。前脚での味の感じ方に変化が生じた場合、それまでとは異なる植物を選択する集団が現れて、棲み分けによる隔離を出発点とする同所的種分化という現象を引き起こしたのではないかと考えられる。
セリ科食性のキアゲハ(Papilio machaon)は、アゲハチョウの仲間では新しいグループとされており、ミカン科食性のナミアゲハと共通の祖先から分化したと考えられている。産卵刺激物質受容システムに関わる遺伝子群を解明し、近縁種間で比較することができれば、食草転換を原動力として起きた進化という現象のメカニズムを理解する重要な手がかりになると考えた。
昆虫の味覚に関する研究が本格的に始まったのは30年以上遡るが4、味覚受容体は2000年になって初めて7回膜貫通型受容体(以下7TMRと略)が報告された5。化学受容の7TMRは一次構造の多様性が高く、脊椎動物から報告されている味覚・嗅覚の7TMRに対する類似性を手がかりとした探索は困難であり、ショウジョウバエの全ゲノム配列6の情報科学的解析によって候補遺伝子ファミリーが同定された。近年は多くの昆虫の全ゲノムが解読されているが、味覚受容体遺伝子はゲノムからコンピュータで解析されたものに限られている。興味深いことに、これまでに報告されている昆虫化学感覚受容体は昆虫間でも類似性に乏しく、それぞれの生活史に合わせて独自の多様化をしている可能性が示唆される。昆虫の味覚受容体は極端に発現量が少ないため解析は困難を極め、機能が解明されているものはまだ少ない7,8。受容体と同様に化学感覚において重要な役割を持つ化合物結合タンパク9について、味覚器官で発現するものが見つかっており10、食草の選択に重要な役割を持つものも報告されている11。ナミアゲハでは、Chemosensory protein (CSP) がゲノムの特定の領域にクラスターしており12、カイコとシンテニーがある事を確認している。
本研究は、主たる食草の産卵刺激物質が明らかにされているアゲハチョウ科昆虫を材料として用い、メス成虫前脚ふ節に発現する味覚受容体遺伝子及び化合物結合タンパク遺伝子をクローニングし、その機能と特徴を明らかにすることを目的として取り組んでおり、昨年度までの取り組みで、ナミアゲハから産卵刺激物質のひとつであるSynephrine(シネフリン)に特異的に応答する受容体を発見し、分子・細胞・神経・行動の全ての面から機能を解明している13。また、電気生理実験により、産卵行動を引き起こすために複数の産卵刺激物質を同時に認識する必要がある仕組みについて、神経プロファイルを解明している14。
今年度は、次世代型シークエンサー(NGS)MiSeqを用い、キアゲハのメス成虫前脚ふ節と触角のRNA-seqを行い、新規の味覚・嗅覚受容体遺伝子を発見した。かつては困難を極めた昆虫化学感覚受容体遺伝子の探索は、NGSによって大幅に高速化できたので、それに対応すべく機能解析の効率化についても検討を行った。
結果と考察
キアゲハのRNA-seqによる新規遺伝子探索
昨年度に構築した長鎖断片作成法により、メス成虫の前脚と触角からRNA-seqライブラリーを作成し、MiSeq Reagent kit V3 600 cycleを用いて各組織約3,000万リードずつ、300塩基のペアエンドで配列を決定した。リード長の分布を確認すると、低分子のライブラリーも少数含まれるものの、280塩基を超える長いものに大きな偏りがあり、クオリティの高いライブラリーを作成できていることを確認した(図1)。
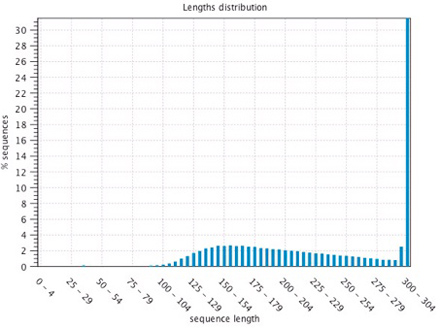
図1 リードの長さの分布
長いリードが多く、クオリティの高いライブラリーが作成できている。
これらリードはTrinity15を用いてde novoアセンブルを行い、コンティグを作成した。得られたコンティグFASTAファイルを用い、ナミアゲハの化学感覚受容体候補と、NCBIの公開データベースから取得した昆虫化学感覚受容体に対してBLAST検索を行い、ヒットしたものをキアゲハの受容体遺伝子候補として抜き出した。その結果、完全長と期待できるコンティグは少なく、味覚受容体候補では3、嗅覚受容体候補では7であった。多くはアセンブルに問題があり、断片化したコンティグが多数あると考えられる。特に、味覚受容体候補は全長率が低い傾向にあるが、この結果は昨年度のナミアゲハのRNA-seqアセンブル結果と類似する。ナミアゲハはドラフトゲノムを構築しているので、RNA-seqのコンティグをマッピングすることでアミノ酸コード領域の全長を推定することができるが、キアゲハのゲノムはまだ作成できていないため、RNA-seqのコンティグをマッピングすることができず、全長配列の推定が行えていない。このため、現時点では候補となる遺伝子の数は未解明である。
キアゲハ触角のRNA-seqからは、全ての昆虫が持つ嗅覚共受容体(Orco)16の完全長配列が見つかった。キアゲハOrco(PmacOrco)のコンティグは、アミノ酸コード領域の前後にUTRを含む完全長配列が構築できており、アミノ酸配列をナミアゲハOrco(PxutOrco)と比較すると、ほぼ完全に保存されていた(図2)。Orcoは昆虫の化学感覚受容体では珍しく、多くの種で保存されていることが知られているが、このアライメント結果に観察されるほぼ完全一致に近い高い保存性は、ナミアゲハとキアゲハが近縁であることを裏付けていると考えられる。

図2 Orcoのアミノ酸配列アライメント
ナミアゲハとキアゲハで、高い保存性が観察された。
キアゲハふ節のRNA-seqからは、ナミアゲハのシネフリン受容体PxutGr1にホモロジーを示すコンティグが見つかった。ただし、完全長配列は構築されておらず、複数のコンティグに分断されていた。PxutGr1にホモロジーを示すコンティグを集め、手作業でつなぎ合わせることでコード領域のおおよそ35%を推定することができた(図3)。
味覚受容体はまだ全長を構築できている割合が低いので、今後はペアエンド同士でオーバーラップする部分がある場合に、アセンブルの前に予め結合しておくなど、アセンブル条件を検討する必要がある。シネフリンはやや珍しい化合物で、これを持っている植物は多くない。シトラス属のみというわけではないが、シトラス属植物の特徴的な物質である。食草をセリ科植物に変更することで誕生したキアゲハが、シネフリン受容体と配列類似性の高い受容体遺伝子を持っており、実際に前脚で発現していることは実に興味深い。全長配列を取得とリガンドの同定を試みたい。
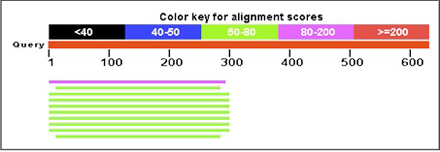
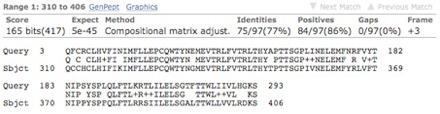
図3 PxutGr1にホモロジーを示すキアゲハ前脚のコンティグ
PxutGr1のコード領域は1,224塩基であるが、同じ長さであると仮定した場合、約35%となる290塩基ほどのコンティグを作成できた。上段: 約620塩基のコンティグのうち、前側の290塩基がPxutGr1のC末端側に類似性を示した。下段: アミノ酸配列のアライメント。Queryはキアゲハのコンティグ、SbjctはPxutGr1。
受容体機能解析の高効率化
次世代シークエンサーの活用により、解析対象となる化学感覚受容体遺伝子の探索は大幅に高速化されている。これに伴い、発見された分子群の機能解析のハイスループット化も今後の重要な課題である。従来の方法はRNAiと電気生理学的解析を用いて1感覚子単位でリガンドに対応する受容体の関係を調べていくものであるが、受容体候補遺伝子とリガンドの組み合わせは膨大になり、対応する組み合わせを見つけ出すには大きな労力が必要となる。そこで、実験を効率化するためにいくつかの方法を考え検討した。
1. 全感覚子の刺激
まず、前脚ふ節の全感覚子から電気的応答を取り、受容体候補遺伝子をRNAiでノックダウンした場合に減少するスパイクを観察し、リガンドを同定できないか検討した。ガラスシャーレに刺激液を満たして記録電極をつなぎ、上方から不関電極をつないだ前脚ふ節をマニュピレータで操作し、刺激液に接触させた(図4)。ふ節感覚子内には化学受容細胞と機械刺激受容細胞が存在し、後者は物理的な刺激により発火する。本実験では、機械刺激受容細胞からの電気シグナルはノイズとなるため発火させないよう注意し、ゆっくりと操作した。しかし、この方法では、注意深く操作したとしてもふ節が水面に接するときに水の表面張力によって感覚子が引き寄せられ、水面に勢いよく叩きつけられる。そのため、機械受容細胞を刺激してしまうのである。この問題は、ミネラルオイルを水面に数滴垂らし表面張力を緩和することで改善できたが、次の問題は電極の体積が巨大化することにより実験機器周辺の電気的なノイズが記録されてしうことであった。通常のチップレコーディング法であれば、先端径10µm程のガラス電極内部に刺激液を充填し、一本の感覚子にかぶせるようにして活動電位を記録する。生じた電気シグナルは直接、絶縁体のガラス電極内を通じ記録電極へ移行するため、ノイズが干渉することは無い。ところが、この方法では刺激液を満たしたガラスシャーレ上部は前肢が水面に接することができるようオープンな状態になっているため、シャーレ上部より電気的ノイズが侵入してシグナルとともに記録されてしまうと考えている。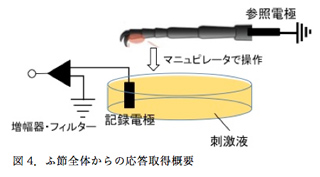
2. ガラス電極径の大型化
装置の変更を最小限にしつつ複数の感覚子からシグナルを得る目的で、従来から使用していたガラス電極の先端径を大きくし、複数本の感覚子を同時に刺激できないか検討した。先端径を大きくし過ぎるとノイズが侵入してしまう恐れがあったため、100、200、300µmの先端径を持つガラス電極を作製し、予備実験を行った。先端径が300µmであってもノイズが侵入する事はなかったが、先端径が広がり刺激液の保持力が弱くなるためか、複数の感覚子に刺激液を接触させると感覚子をつたって刺激液が漏れてしまうという現象が生じた。扱いやすさの点を考慮して先端径100µmのガラス電極を計測に用いる事とした。ミカン葉抽出液を刺激液として応答を取得したところ、複数の感覚子からの応答と見られるシグナルを得る事ができた(図5)。しかし、ガラス電極の径が大きいことで、一回の操作で複数の感覚子が接触のターゲットとなり、ガラス部分で触れてしまう可能性が増加した。ガラス部分が触れると機械刺激受容細胞細胞が応答してしまい、目的のシグナルとの区別が困難となる。

3. 複数の遺伝子を同時に発現阻害
1本の感覚子から電気的応答を取得するという基本的な実験方法は変更せずに、RNAiに使用するdsRNAと産卵刺激物質の組み合わせを工夫する事で実験を効率化する方法を検討している。19種類の受容体候補遺伝子を5種類程度ずつにグループ分けし、それらのdsRNAを混合してチョウに注射し、同時に発現を阻害する。10種類の産卵刺激物質のうち5種類は水溶液に溶けやすく実験が容易であるため、どの物質がどの味覚感覚神経を刺激するか解明済みである14。異なる神経細胞を興奮させる化合物を組み合わせて電気応答を取得し、応答が消失した細胞を観察することで産卵刺激物質が特定できる(図6)。例えば、高電圧細胞を刺激するスタキドリン・中電圧細胞を刺激するナリルチン・低電圧細胞を刺激するメチルトリプトアミンを混合して感覚子を刺激した際に、高電圧細胞の応答が消失すれば、発現を阻害した5種類の候補遺伝子の中にスタキドリンの受容体遺伝子が含まれていることになる。次に、候補遺伝子5種類を一つずつ発現阻害し、スタキドリンに対する応答を観察することで、リガンドを特定できると考えている。既に確立している実験手法の応用で、リガンド解析のハイスループット化が可能になると期待している。
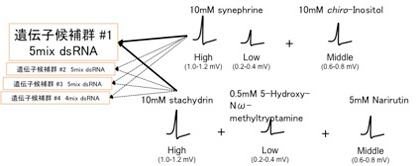
図6 レセプター探索効率化
混合の組み合わせ例
ふ節感覚子味覚神経の投射先は脳である可能性
前脚ふ節で認識した味覚の情報は、脳に投射されてなんらかの処理を経て産卵行動が誘発されているのか、脳を経ずに反射的に腹部を曲げているのか、現時点では未解明である。頭部が産卵行動に関与しているのか調べるため、頭部を切断したナミアゲハで産卵実験を行った(図7)。多くの昆虫がそうであるように、ナミアゲハも頭部を切断した後も数時間から数日は生きており、歩いたり羽ばたいたりすることができる。交尾済みのナミアゲハのメス成虫を、通常の産卵実験と同様に照明を当てて産卵行動を活性化させ、クリップで翅を抑えた状態でミカン葉抽出物を染み込ませたろ紙に前脚を触らせると、産卵するために腹部を曲げる行動が観察される。腹部を曲げる行動を観察した後に頭部を切断し、同じろ紙を触らせても腹部を曲げる行動は観察されなくなる。
アゲハチョウ個体に対するダメージが大きく、あまりにも乱暴な実験ではあるが、前脚で感じた味覚の情報が脳に投射され、なんらかの処理を経て産卵行動が起きている可能性を示すことができたのではないだろうか。

おわりに
今年度の取り組みにより、キアゲハから少数ではあるものの化学感覚受容体遺伝子を見つけることができ、近縁種間で比較を行うことができる土台が整いつつある。部分的にではあるが、ナミアゲハのシネフリン受容体PxutGr1に高い保存性を示す新規遺伝子が、キアゲハから見つかったことは興味深い。RNA-seqのリードを通常の方法でde novoアセンブルした場合、ほぼ全長と思われるコンティグ配列が得られている遺伝子も多数あるものの、化学感覚受容体は短い複数のコンティグに分かれている傾向が強い。アセンブルを行う前の処理や、アセンブル時の条件を検討し、化学感覚受容体の全長率を改善する工夫が必要である。また、ラフな状態でも良いので、ゲノムの配列があると新規遺伝子探索に有利な面が多いので、キアゲハをはじめ数種のアゲハチョウについてゲノムを構築したいと考えている。
新規受容体遺伝子の機能解析は、いくつか問題があったものの既に確立済みの実験手法の応用でハイスループット化が可能になる目処が立った。この方法で実際にリガンドを同定できるか取り組んでいきたい。
謝辞
本研究の遂行にあたり、吉川寛非常勤顧問(BRH)、谷村禎一准教授(九大)、Frederic Marion-Poll教授(INRA)、小寺正明講師(東工大)、武藤愛助教(奈良先端大)、坂本昇研究員(伊丹市昆虫館)、角正美雪研究員(伊丹市昆虫館)、澤田実氏(北海道札幌市)に多大な協力と助言を頂いた。
引用文献
- 1 Thompson, J. N. Evolutionary genetics of oviposition preference in swallowtail butterflies. Evolution 42, 1223-1234 (1988).
- 2 Ohsugi, T., Nishida, R. & Fukami, H. Multi-component system of oviposition stimulants for a Rutaceae-feeding swallowtail butterfly, Papilio xuthus. Applied Entomology and Zoology 26, 29-40 (1991).
- 3 Feeny, P., Rosenberg, L. & Carter, M. in Herbivorous Insects: Host-seeking Behavior and Mechanisms (ed S. Ahmad) 27-76 (Academic Press, 1983).
- 4 Tanimura, T., Isono, K., Takamura, T. & Shimada, I. Genetic dimorphism in the taste sensitivity to trehalose in Drosophila melanogaster. J. Comp. Physiol. 141, 433-437 (1982).
- 5 Clyne, P. J., Warr, C. G. & Carlson, J. R. Candidate taste receptors in Drosophila. Science 287, 1830-1834, doi:8337 [pii] (2000).
- 6 Myers, E. W. et al. A whole-genome assembly of Drosophila. Science 287, 2196-2204, doi:8395 [pii] (2000).
- 7 Chyb, S., Dahanukar, A., Wickens, A. & Carlson, J. R. Drosophila Gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A 100 Suppl 2, 14526-14530 (2003).
- 8 Jones, W. D., Cayirlioglu, P., Kadow, I. G. & Vosshall, L. B. Two chemosensory receptors together mediate carbon dioxide detection in Drosophila. Nature 445, 86-90 (2007).
- 9 Ozaki, M. et al. Ant nestmate and non-nestmate discrimination by a chemosensory sensillum. Science 309, 311-314 (2005).
- 10 Galindo, K. & Smith, D. P. A large family of divergent Drosophila odorant-binding proteins expressed in gustatory and olfactory sensilla. Genetics 159, 1059-1072 (2001).
- 11 Matsuo, T., Sugaya, S., Yasukawa, J., Aigaki, T. & Fuyama, Y. Odorant-binding proteins OBP57d and OBP57e affect taste perception and host-plant preference in Drosophila sechellia. PLoS Biol 5, e118, doi:06-PLBI-RA-0167R3 [pii]10.1371/journal.pbio.0050118 (2007).
- 12 Ozaki, K., Utoguchi, A., Yamada, A. & Yoshikawa, H. Identification and genomic structure of chemosensory proteins (CSP) and odorant binding proteins (OBP) genes expressed in foreleg tarsi of the swallowtail butterfly Papilio xuthus. Insect Biochem Mol Biol 38, 969-976, doi:S0965-1748(08)00133-1 [pii]10.1016/j.ibmb.2008.07.010 (2008).
- 13 Ozaki, K. et al. A gustatory receptor involved in host-plant recognition for oviposition of the butterfly, Papilio xuthus. Nature communications 2:542 (2011).
- 14 Ryuda, M. et al. Gustatory sensing mechanism coding for multiple oviposition stimulants in the swallowtail butterfly, papilio xuthus. J Neurosci 33, 914-924, doi:10.1523/JNEUROSCI.1405-12.2013 33/3/914 [pii] (2013).
- 15 Grabherr, M. G. et al. Full-length transcriptome assembly from RNA-Seq data without a reference genome. Nat Biotechnol 29, 644-652, doi:10.1038/nbt.1883 (2011).
- 16 Sato, K., Pellegrino, M., Nakagawa, T., Vosshall, L. B. & Touhara, K. Insect olfactory receptors are heteromeric ligand-gated ion channels. Nature 452, 1002-1006, doi:nature06850 [pii]10.1038/nature06850 (2008).
- 17 Murata, T., Mori, N. & Nishida, R. Larval feeding stimulants for a rutaceae-feeding swallowtail butterfly, Papilio xuthus L. in Citrus unshiu leaves. J Chem Ecol 37, 1099-1109, doi:10.1007/s10886-011-0022-5 (2011).
