年度別活動報告
年度別活動報告書:2011年度
アゲハチョウの食草選択と進化
尾崎 克久(研究員) 龍田 勝輔(奨励研究員)
廣嵜 由利恵(研究補助員)
はじめに
動物は、外界に存在する化合物を味覚・嗅覚として認識している。陸棲生物においては、水溶性・脂溶性化合物を感覚器官が接触して認識するものを味覚、揮発性化合物を非接触的に認識するものを嗅覚と呼ぶ。化学感覚(味覚・嗅覚)は、生物間のコミュニケーションにとって不可欠な機能であり、寄主選択・配偶行動・集団生活の維持・社会性の構築など、生存上の様々な機能を支えている。寄主選択に関わる化学受容の仕組みに変化が生じた場合、それまでとは異なる空間を生息の場として利用する集団が現れ、住み分けが何世代にもわたって繰り返されることによって種分化へとつながる。このような変化は、進化の歴史を物語る証拠としてゲノムに刻まれる。動物と環境との関わりにおいて中心的な機能である味覚や嗅覚といった化学受容に関わる分子機構の解明は、多様化、種分化、適応の仕組みを解明するために、最も有力な手がかりになると考えられる。
アゲハチョウの仲間は、他の多くの植食性昆虫と同様に特定の植物のみを餌として利用する単食性に近い寄主選択をしており、寄主選択とアゲハチョウ科の進化には相関関係が認められる1)。卵から孵化したばかりのアゲハチョウの幼虫は、体が小さく移動能力が低いため、広い環境中を歩き回って自力で餌を探索することは困難である。そのため、メス成虫による正確な植物種の識別と産卵場所の選択は、次世代の生存に決定的な影響を与えることになる。メス成虫は産卵の直前に前脚で植物に触れることで、前脚ふ節にある化学感覚子を通じて含有する化合物を感じ取り、その組み合わせによって産卵行動が引き起こされる。前肢ふ節の感覚子数は雌雄間で大きな差があり、圧倒的にメスに多く、メスのみが行う行動、つまり産卵において重要な役割を持つことが知られている。ナミアゲハ(Papilio xuthus)では、主な食草であるウンシュウミカンの葉から産卵刺激物質として10種類の化合物が単離されている2)。他にも数種のアゲハ類で産卵刺激物質が明らかにされており、これらの構造について、アゲハ種間で比較すると類似性が認められる。このことから、植物の系統的近縁性とは無関係に、植物に含まれている化合物の類似性が寄主転換の可能性を支え、食性の進化を可能にしたのではないかと考えられている3)。これまでに報告されている産卵刺激物質は全て不揮発性で、前脚ふ節で接触して感じていることから、アゲハチョウは前脚で「味」として認識していると考えられている。前脚での味の感じ方に変化が生じた場合、それまでとは異なる植物を選択する集団が現れて、住み分けによる隔離を出発点とする同所的種分化という現象を引き起こしたと考えられる。
ミカン科食性のアゲハチョウ間であっても、種ごとに産卵刺激物質として認識する化合物の組み合わせが異なるため、種ごとに特徴的で多様な味覚受容体を持っていることが予測される。また、味覚受容体が化合物を認識するためには、化合物が化学感覚子内のリンパ液を通り抜けて受容体に到達する必要があるため、化合物を結合して運搬する役割を持つタンパクが必要になると考えられる。味覚受容体と化合物結合タンパクを中心とする産卵刺激物質受容システムに関わる遺伝子群を解明し、複数種間で比較することができれば、食草転換を原動力として起きた進化という現象のメカニズムを理解する重要な手がかりになると考えた。
昆虫の味覚に関する研究が本格的に始まったのは30年近く前に遡るが4)、味覚受容体は2000年になって初めて7回膜貫通型受容体(以下7TMRと略)が報告された5)。化学受容の7TMRは一次構造の多様性が高く、脊椎動物から報告されている味覚・嗅覚の7TMRに対する類似性を手がかりとした探索は困難であり、ショウジョウバエの全ゲノム配列の情報科学的解析によって候補遺伝子ファミリーが同定された。これまでに7種の昆虫の全ゲノムが解読されているが、味覚受容体遺伝子はゲノムからコンピュータで解析されたものに限られている。昆虫の味覚受容体は極端に発現量が少ないため解析は困難を極め、機能が解明されているものはまだ少ない6, 7)。化合物結合タンパクについて、味覚器官で発現するものが見つかっており8)、食草の選択に重要な役割を持つものも報告されている9)。ナミアゲハでは、Chemosensory protein (CSP) がゲノムの特定の領域にクラスターしており10)、カイコとシンテニーがある事を確認している。また、多種昆虫から化合物結合タンパクの遺伝子が報告され、情報が蓄積されつつある。
本研究は、主たる食草の産卵刺激物質が明らかにされているナミアゲハを主な材料として用い、メス成虫前脚ふ節に発現する味覚受容体遺伝子及び化合物結合タンパク遺伝子をクローニングし、その機能と特徴の解明を目的として取り組んでいる。 昨年度までの取り組みで、ナミアゲハからメス成虫前脚ふ節に発現の特異性を示す7回膜貫通型タンパク質遺伝子(PxutGr1)を発見し、バキュロウイルス発現系を用いたカルシウムイメージング法により産卵刺激物質の一つであるSynephrine(シネフリン)に特異的に応答する受容体である事を解明している。また、RNAi法を用いた機能阻害と電気整理実験・産卵行動実験に取り組んだ結果、PxutGr1の発現を阻害したナミアゲハでは、Synephrineに対する感度が低下し、産卵行動が抑制されることを確認している。これらの結果から、ゲノムが読まれていない昆虫から初めて味覚受容体遺伝子を同定し、産卵という本能行動に関与していることを明らかにした11)。
今年度は、CSP・OBPの機能解析に向けた取り組み、解読が始まったアゲハチョウゲノムの初期アセンブルから7回膜貫通型受容体の探索に取り組んだ。
結果と考察
1. アゲハチョウ科3種のOBP (Odorant binding protein)、CSP (Chemosensory protein)の機能解析
本研究室では、産卵刺激物質が同定されているアゲハチョウ科3種の前肢跗節からcDNAライブラリーを作製し、Odorant binding protein (OBP)、Chemosensory protein (CSP)などの化学感覚に関わる分子も同定している10),未発表。OBP・CSPは化学感覚子内のアクセサリー細胞から感覚子内のリンパ液に多量に分泌された水溶性タンパク質であり、主に味・匂い物質のリンパ液への可溶化と運搬に関与していると考えられている8, 19)。さらに、OBPの発現の有無がショウジョウバエ近縁種間での広食性から単食性への食性転換に寄与した可能性も示されているため9)、寄主植物の味物質を手がかりとして寄主選択を行うアゲハチョウ科昆虫においても、OBP、CSPが重要な役割をもつ可能性がある。そこで、本研究ではアゲハチョウ科昆虫のOBP、CSPの機能解析をすることにより産卵刺激物質受容に関わるOBP、CSPの解明を試みている。アゲハチョウの味覚感覚子で発現している候補OBP、CSPを選出するため、RT-PCRによってアゲハチョウ科3種のOBP、CSPの発現時期および組織(部位)を確認してきた。
前年度までに、産卵刺激物質が同定されているアゲハチョウ科3種のうち、ナミアゲハとシロオビアゲハの前肢跗節からcDNAライブラリーを作製し1万〜2万クローンの塩基配列を決定している。今年度はクロアゲハからcDNAライブラリーを作製し、2万クローンの塩基配列を決定した。得られたシークエンスをクラスタリングし、ナミアゲハのOBP、CSPのアミノ酸配列もしくはNCBIに登録されている全てのタンパク質、ペプチドのアミノ酸配列情報をデータベース化しBlastXによる相同性検索を行った結果、クロアゲハから9種類のOBPと13種類のCSPを同定した。さらにすでに作製されていたナミアゲハとシロオビアゲハのcDNAライブラリーの相同性検索を再度行った結果、シロオビアゲハから新たに9種類のOBP、ナミアゲハからOBP4を発見した。これらOBP、CSPの中には各種アゲハが独自にもつOBP、CSPが存在した。COⅠ、COⅡ、EF-1α領域のアミノ酸配列による系統解析によると、シロオビアゲハとクロアゲハはアゲハチョウ科の中でも近縁であるが20)、種ごとに独自のOBP、CSPを持ち、異なる化合物の認識に利用している可能性が考えられる。
次に、OBP、CSPの機能推定のため、その発現時期および組織(部位)をRT-PCRによって確認した(表1)。雌成虫の前肢(Fl)、中肢(Ml)、後肢(Hl)、触角(An)、口吻(Pr)、頭部(He)、胸部(Th)からそれぞれ、2μgのtotal RNAを抽出後、cDNAを作製しPCR用の鋳型として用いた。OBP、CSPともに全身で発現しているものから、一部に局在しているものまで様々であり、味覚受容器官(組織)のみで発現しているOBP、CSPはなかった(表1)。現在までに発現パターンを確認できたOBP、CSPの中で、跗節、口吻、触角といった味覚、嗅覚受容器官でのみ発現しているものは、ナミアゲハCSP5、OBP3、OBP4の3種類、シロオビアゲハCSP5、CSPaの2種類、クロアゲハCSP8a、CSP8b、CSP9、OBP4〜10の10種類であった。なお、ナミアゲハ、クロアゲハの雄成虫でも同様に組織別発現部位を調べた結果、各種雌成虫の発現パターンとほとんど違いはなかったものの、ナミアゲハOBP3は雄成虫では発現せず、雌成虫の前肢、触覚でのみ発現していることがわかった(雄成虫データは未記載)。
アゲハチョウ科3種間でOBP・CSPの発現の有無を比較すると、発現するOBP・CSPの種類はアゲハ種間でまったく異なっており、ナミアゲハを例にとると、他2種よりもCSPが多く、OBPは少ないという結果が得られた。跗節cDNAライブラリーのみの情報であるため、各種アゲハで発見できなかったOBP・CSPがゲノム上に存在しないことを示すものではないが、跗節での発現パターンの違いが味覚の違いに関与する可能性も考えられる。ナミアゲハ跗節感覚子のほとんどが水、糖、塩といった摂食行動に必須な味物質ではなく、産卵刺激物質に応答する感覚子であることが電気生理学的解析により明らかになっていることや(2010年度年間報告に記載)、アゲハチョウ科3種がシネフリンやスタキドリンを除いて異なる化合物を産卵刺激物質として利用していることを考慮すると、アゲハチョウ科種間で発現の有無が異なるOBP・CSPが産卵刺激物質応答に関与する可能性に期待できる。
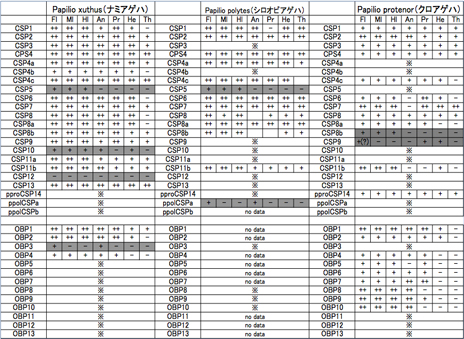
表1 アゲハチョウ科3種OBP、CSPの組織別発現パターン(雌成虫)
味・嗅覚組織で発現している候補OBP、CSPの発現パターンを灰色枠で示した。no dataは各種cDNAライブラリーから発見されているが、発現パターン解析を行えていないOBP、CSP、※は各cDNAライブラリーから発見できなかったOBP、CSPを示す。
組織名:Fl (foreleg) 前肢、Ml (midleg) 中肢、Hl (hindleg) 後肢、An (antenna) 触角、Pr (proboscis) 口吻、He (head) 頭部、Th (thorax) 胸部
ナミアゲハのデータは宇戸口(2008年修論)を追試したもの、シロオビアゲハのデータは山田(2006年修論)を使用
次に、幼虫期のOBP、CSP発現時期、組織を調べ、成虫期との発現パターンを比較した(表2)。なお、幼虫期のデータは現段階でナミアゲハのみ取得している。幼虫期においてもOBP、CSPの発現パターンは多様であり、全身で発現するものから、味覚、嗅覚器官に局在するものまで存在した。CSP1やCSP5は幼虫期に発現しておらず、特にCSP5は成虫期でも跗節でのみ発現していることから、成虫期特異的な化学感覚に関与している可能性がある。また、OBP3は成虫期、幼虫期ともに味覚・嗅覚器官でのみ特異的に発現しており、前述のように雄成虫では発現が確認できなかったことから、産卵刺激物質受容に関わる可能性が示唆される。また、幼虫期に味覚・嗅覚器官で特異的に発現していても、成虫期にはほぼ全身で発現しているCSP7・CSP9が存在することから、幼虫期と成虫期ではその役割を変化させているのかもしれない。さらに、幼虫齢間で発現組織や発現の有無を変化させるCSP6、CSP10、OBP4なども存在した。OBP4は終齢幼虫期の味覚感覚子と精巣でのみ発現しており、味覚受容と生殖機能の両方に関与する可能性を持つ。このように、OBP、CSPが本来、味覚・嗅覚器官ではない部位で発現していることは、他の昆虫でも報告されている21)。これらのOBP、CSPは生命維持に必須な一次代謝系に関わる役割を持つか、発生、脱皮、変態等に関わる重要分子のキャリヤーとしての機能を持つと考えられている21, 22)。アゲハチョウ科昆虫OBP・CSPの化学感覚機能解析に向けて、別の機能を有する可能性を十分に考慮する必要がある。
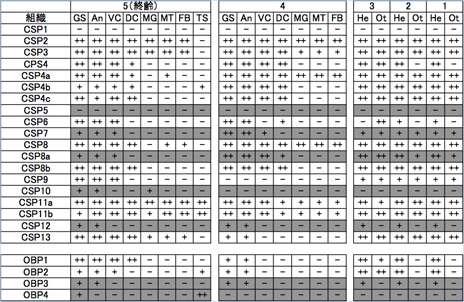
表2 ナミアゲハ幼虫のOBP、CSPの齢期別、組織別発現パターン
幼虫、成虫期に味・嗅覚組織で特異的に発現する候補OBP、CSPの発現パターンを灰色枠で示した。
組織名:GS(gustatory sensilla)味感覚子、An(Antenna)触角、VC(ventral cuticle)腹側表皮、DC(dorsal cuticle)背側表皮、MG(midgut)中腸、MT(malpighian tube)マルピーギ管、FB(fat body)脂肪体、TS(testis)精巣、He(head)頭部・・(GS Anを含む)、Ot(others)頭部以外(VC DC MG MT FB (TS)を含む)
ナミアゲハ成虫期と幼虫期のOBP・CSPの組織別・時期別発現部位を調べることにより、これまで多くの昆虫種から発見されたOBP、CSPと同様に、多様な機能を持つ可能性が示唆されたとともに、味覚受容器官で発現する候補OBP・CSPを選定することができた。今後は選定したOBP・CSPの機能解析のため、これまでの研究で取り組んできたRNAi法やin vivo系、in vitro系実験およびHPLCになどの分析を用いて、化合物との結合活性の解明に取り組みたいと考えている。
2. アゲハチョウゲノムから味覚受容体遺伝子を探索
2010年より、新学術領域のゲノム支援を受けて、ナミアゲハとシロオビアゲハのゲノム解読が始まっている。野生型ナミアゲハのゲノムDNAを出発材料として、第2世代型シークエンサー2機種(Illumina HiSeq 2000、Roch 454 GS FLX)を用いて200倍を超える重複率のゲノム配列を産出し、第一段階のアセンブルで N50=が約140Kb の scaffold が得られた。scaffold サイズはまだ小さく、ギャップ率が約20%であるため、今後更なる改善が必要ではあるものの、昆虫の味覚受容体遺伝子を探索するためにはゲノム解読が最も有力な手段となるので大きな前進と言える。ナミアゲハの PxutGr1 を除き、現在知られている味覚受容体遺伝子は全てゲノムからコンピュータを使って検出されているのである。
昆虫の味覚受容体遺伝子は一次構造が多様で保存性が極端に低く、他の生物種で見つかっている配列情報を手がかりとして利用することができない。また、ゲノム配列から遺伝子領域を予測するアルゴリズムを用いても、化学受容体遺伝子の検出は難しいとされている。そのため、Blast 検索23)の技術を応用した PSI-tBLASTn 24)という手法で探索するのが一般的である。PSI-tBLASTn は、配列の類似性は乏しくても構造的特徴の類似性を元に探索できる PSI-BLAST と、Query として用いたアミノ酸配列をコードしうる全ての塩基配列に自動で変換し、塩基配列データベースを探索する translation BLAST (tBLASTn) を巧みに組み合わせた探索手法である。
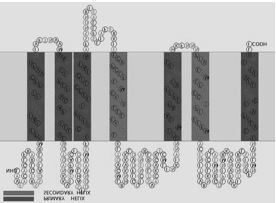
図7 新規味覚受容体候補の膜貫通トポロジー(SOSUI)
7回膜貫通型と推定され、C-末端が短いという典型的な昆虫化学受容体の特徴を有する。
PxutGr1 アミノ酸配列を Query として、PSI-BLAST を5サイクル行い PSSM (position specific scoring matrix; 位置依存スコア行列。アミノ酸など生物学的な配列からモチーフ[パターン]を見いだすために使われる) 24)を産出し、得られた PSSM を用いて tBLASTn を行い、472個の部分的配列がヒットした。ヒットした配列から手作業で遺伝子候補領域を抜き出し、全アミノ酸配列データベースを検索することで、37個が既知の味覚受容体にホモロジーを示した。そのうちの一つはPxutGr1 に完全に一致し、残りの36個が新規の候補遺伝子となった。36個の候補遺伝子のうち、少なくとも5つはシングルエクソンと考えられ、予想される全長配列が取得できた。これらをアミノ酸配列に変換し、膜貫通領域解析アルゴリズムSOSUI25)でトポロジーを解析すると、7回膜貫通型であることを示した(図7)。これらアミノ酸配列を NCBI のサーバーで BlastP を用いた探索を行うと 7tm_7 ファミリーに分類され、典型的な昆虫化学受容体ファミリーの膜トポロジーを有することが示された。また、シングルエクソンの候補遺伝子のうち、4つは同一の scaffold 上に存在し、クラスターを形成していることを確認した。シングルエクソンであることから、これらはレトロボゾンによって挿入された可能性があるのではないだろうか。
以上の結果から、初期的で完成度の低いゲノム配列であっても、新規遺伝子の探索には有益であると考えられる。しかし、現在は scaffold の配列中に約20%ものギャップが存在するため、全長配列が取得できない遺伝子も多い。今後の解析により、ギャップが埋まることで更に多くの遺伝子を見いだせる可能性がある。RNA-seq 26, 27)により mRNA 全長配列のデータベースを構築できれば、上記部分配列の候補遺伝子のコード領域全長を取得できる可能性がある。次世代型シークエンサーを有効に活用することで、数種アゲハチョウの味覚関連遺伝子群をゲノムワイドに探索し、比較することが可能になると期待できる。昆虫の化学感覚には、7回膜貫通型のGr・Or の他にイオンチャンネル内蔵型受容体(IR: ionotropic receptor)28, 29)も関与していることが示唆されているので、同様の探索を行う必要がある。
おわりに
今年度の研究成果により、昆虫の味覚受容体は嗅覚受容体と異なり、共受容体(co-receptor)がなくても生体内で機能しうる可能性が示唆された。嗅覚の場合は Orco が全ての昆虫で保存されており、全ての嗅覚受容体にとって Orco とのヘテロダイマー形成が必須となっているのに対し、味覚受容体の場合は共受容体が見つかっていない。ショウジョウバエの生体内でナミアゲハのシネフリン受容体 PxutGr1 が機能したことは、味覚と嗅覚で仕組みが異なる可能性を示唆しており、興味深い発見である
今後は、ゲノムワイドな視点から遺伝子を探索し、タンパク質の機能を行動に結びつけてゆく包括的な研究により、植食性昆虫の食草選択と進化について理解を深めていきたいと考えている。
謝辞
本研究の遂行に当たり、吉川寛顧問に多大な助言を頂いた。電気生理実験は、共同研究者である九州大学谷村禎一准教授の機器を使用した。
引用文献
- 1 Thompson, J. N. (1988) Evolutionary genetics of oviposition preference in swallowtail butterflies. Evolution42: 1223-1234.
- 2 Ohsugi, T., Nishida, R. and Fukami, H. (1991) Multi-component system of oviposition stimulants for a Rutaceae-feeding swallowtail butterfly, Papilio xuthus. Applied Entomology and Zoology 26: 29-40.
- 3 Feeny, P. (1995) Ecological opportunism and chemical constraints on the host associations of swallowtail butterflies. In: Swallowtail Butterflies: Their Ecology and Evolutionary Biology (Scriber, J, Tsubaki, Y and Lederhouse, R, eds.). pp. 9-15. Scientific Publishers, Gainesville, Florida.
- 4 Tanimura, T., Isono, K., Takamura, T. and Shimada, I. (1982) Genetic dimorphism in the taste sensitivity to trehalose in Drosophila melanogaster. J. Comp. Physiol. 141: 433-437.
- 5 Clyne, P. J., Warr, C. G. and Carlson, J. R. (2000) Candidate taste receptors in Drosophila. Science 287: 1830-4.
- 6 Chyb, S., Dahanukar, A., Wickens, A. and Carlson, J. R. (2003) Drosophila Gr5a encodes a taste receptor tuned to trehalose. Proc Natl Acad Sci U S A 100 Suppl 2: 14526-30.
- 7 Jones, W. D., Cayirlioglu, P., Kadow, I. G. and Vosshall, L. B. (2007) Two chemosensory receptors together mediate carbon dioxide detection in Drosophila. Nature 445: 86-90.
- 8 Galindo, K. and Smith, D. P. (2001) A large family of Drosophila odorant-binding proteins expressed in gustatory and olfactory sensilla. Drosophila 159: 1059-72.
- 9 Matsuo, T., Sugaya, S., Yasukawa, J., Aigaki, T. and Fuyama, Y. (2007) Odorant-binding proteins OBP57d and OBP57e affect taste perception and host-plant preference in Drosophila sechellia. PLoS Biol 5: e118.
- 10 Ozaki, K., Utoguchi, A., Yamada, A. and Yoshikawa, H. (2008) Identification and genomic structure of chemosensory proteins (CSP) and odorant binding proteins (OBP) genes expressed in foreleg tarsi of the swallowtail butterfly Papilio xuthus. Insect Biochem Mol Biol 38: 969-76.
- 11 Ozaki, K., Ryuda, M., Yamada, A., Utoguchi, A., Ishimoto, H., Calas, D., Marion-Poll, F., Tanimura, T. and Yoshikawa, H. (2011) A gustatory receptor involved in host-plant recognition for oviposition of the butterfly, Papilio xuthus. Nature communications2:542.
- 12 Brand, A. H. and Perrimon, N. (1993) Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development 118: 401-415.
- 13 Shimomura, O., Johnson, F. H. and Saiga, Y. (1962) Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. Journal of Cellular and Comparative Physiology 59: 223-239.
- 14 Ja, W. W., Carvalho, G. B., Mak, E. M., de la Rosa, N. N., Fang, A. Y., Liong, J. C., Brummel, T. and Benzer, S. (2007) Prandiology of Drosophila and the CAFÉ assay. Proc. Natl. Acad. Sci. USA 104: 8253-8256.
- 15 Li, Q., Huang, C. and Huang, Y. (2006) Sensitive determination of synephrine by flow-injection chemiLuminescence. Luminescence 21: 43-48.
- 16 Hiroi, M., Marion-Poll, F. and Tanimura, T. (2002) Differentiated response to sugars among labellar chemosensilla in Drosophila. Zoolog Sci 19: 1009-18.
- 17 Weiss, L. A., Dahanukar, A., Kwon, J. Y., Banerjee, D. and Carlson, J. R. (2011) The Molecular and Cellular Basis of Bitter Taste in Drosophila. Neuron 69: 258-272.
- 18 Zhang, H. J., Anderson, A. R., Trowell, S. C., Luo, A. R., Xiang, Z. H. and Xia, Q. Y. (2011) Topological and functional characterization of an insect gustatory receptor. PLoS One 6: e24111.
- 19 Pelosi, P., Calvello, M. and Ban, L. (2005) Diversity of Odorant-binding Proteins and Chemosensory Proteins in Insects. Chem Senses 30 Suppl 1: i291-i292.
- 20 Zakharov, E., Caterino, M. and Sperling, F. (2004) Molecular phylogeny, historical biogeography, and divergence time estimates for swallowtail butterflies of the genus Papilio (Lepidoptera: Papilionidae). Syst Biol 53: 193-215.
- 21 Gong, D. P., Zhang, H. J., Zhao, P., Xia, Q. Y. and Xiang, Z. H. (2009) The Odorant Binding Protein Gene Family from the Genome of Silkworm, Bombyx mori. BMC Genomics 10: 332.
- 22 Maleszka, J., Foret, S., Saint, R. and Maleszka, R. (2007) RNAi-induced phenotypes suggest a novel role for a chemosensory protein CSP5 in the development of embryonic integument in the honeybee (Apis mellifera). Dev Genes Evol 217: 189-96.
- 23 Altschul, S. F., Gish, W., Miller, W., Myers, E. W. and Lipman, D. J. (1990) Basic local alignment search tool. J Mol Biol 215: 403-10.
- 24 Altschul, S. F., Madden, T. L., Schaffer, A. A., Zhang, J., Zhang, Z., Miller, W. and Lipman, D. J. (1997) Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Res 25: 3389-402.
- 25 Hirokawa, T., Boon-Chieng, S. and Mitaku, S. (1998) SOSUI: classification and secondary structure prediction system for membrane proteins. Bioinformatics 14: 378-9.
- 26 Mamanova, L. and Turner, D. J. (2011) Low-bias, strand-specific transcriptome Illumina sequencing by on-flowcell reverse transcription (FRT-seq). Nat Protoc 6: 1736-47.
- 27 Ozsolak, F., Platt, A. R., Jones, D. R., Reifenberger, J. G., Sass, L. E., McInerney, P., Thompson, J. F., Bowers, J., Jarosz, M. and Milos, P. M. (2009) Direct RNA sequencing. Nature 461: 814-8.
- 28 Olivier, V., Monsempes, C., Francois, M. C., Poivet, E. and Jacquin-Joly, E. (2011) Candidate chemosensory ionotropic receptors in a Lepidoptera. Insect Mol Biol 20: 189-99.
- 29 Croset, V., Rytz, R., Cummins, S. F., Budd, A., Brawand, D., Kaessmann, H., Gibson, T. J. and Benton, R. (2010) Ancient protostome origin of chemosensory ionotropic glutamate receptors and the evolution of insect taste and olfaction. PLoS Genet 6: e1001064.
