年度別活動報告
年度別活動報告書:2009年度
アゲハチョウの食草選択と進化
尾崎 克久(研究員) 龍田 勝輔(奨励研究員)
廣嵜 由利恵(研究補助員)
はじめに
化合物の認識は、外界の情報を知る手段として、全ての動物にとって不可欠な行動である。化合物の受容は味覚・嗅覚として認識され、寄主選択、配偶行動、集団生活の維持、社会性の構築など様々な場面で重要な役割を担っている。寄主選択において、化学受容の仕組みに変化が生じた場合、それまでとは異なる空間を生息の場として利用する集団が現れ、住み分けが何世代にもわたって繰り返されることによって種分化へとつながる。このような変化は、進化の歴史を物語る証拠としてゲノムに刻まれる。動物と環境との関わりにおいて中心的な機能である味覚や嗅覚といった化学受容に関わる分子機構の解明は、多様化、種分化、適応の仕組みを解明するために、最も有力な手がかりになると考えられる。
アゲハチョウの仲間は、他の多くの植食性昆虫と同様に、特定の植物のみを餌として利用する単食性に近い寄主選択をしており、寄主選択とアゲハチョウ科の進化には相関関係が認められる1)。卵から孵化したばかりのアゲハチョウの幼虫は、体が小さく移動能力が低いため、自力で餌を探索することは困難である。メス成虫による正確な植物種の識別と産卵場所の選択は、次世代の生存を左右する重要な役割である。メス成虫は産卵の直前に前脚で植物に触れることで含有する化合物を感じ取り、その組み合わせによって産卵行動が引き起こされる。ナミアゲハ(Papilio xuthus)では、ウンシュウミカンの葉から産卵刺激物質として10種類の化合物が単離されている2)。他にも数種のアゲハ類で産卵刺激物質が明らかにされており、これらの構造について、アゲハ種間で比較すると類似性が認められる。このことから、植物の系統的近縁性とは無関係に、植物に含まれている化合物の類似性が寄主転換の可能性を支え、食性の進化を可能にしたのではないかと考えられている3)。これまでに報告されている産卵刺激物質は全て不揮発性であるため、アゲハチョウは前脚で「味」として認識していると考えられている。前脚での味の感じ方に変化が生じた場合、それまでとは異なる植物を選択する集団が現れて、住み分けによる隔離を出発点とする同所的種分化という現象を引き起こしたと考えられる。
ミカン科食性のアゲハチョウ間であっても、種ごとに産卵刺激物質として認識する化合物の組み合わせが異なるため、種ごとに特徴的な多様な味覚受容体を持っていることが予測される。また、味覚受容体が化合物を認識するためには、化合物が化学感覚子内のリンパ液を通り抜けて受容体に到達する必要があるため、化合物を結合して運搬する役割を持つタンパクが必要になると考えられる。味覚受容体と化合物結合タンパクを中心とする産卵刺激物質受容システムに関わる遺伝子群を解明し、複数種間で比較することができれば、食草転換を原動力として起きた進化という現象のメカニズムを理解する重要な手がかりになると考えた。
昆虫の味覚に関する研究が本格的に始まったのは20年以上前に遡るが4)、味覚受容体は2000年になって初めて7回膜貫通型受容体(以下7TMRと略)が報告された5)。化学受容の7TMRは一次構造の多様性が高く、脊椎動物から報告されている味覚・嗅覚の7TMRに対する類似性を手がかりとした探索は困難であり、ショウジョウバエの全ゲノム配列の情報科学的解析によって候補遺伝子ファミリーが同定された。昆虫の味覚受容体は極端に発現量が少ないため解析は困難を極め、直接的な証拠によって機能が解明されているものはまだ少ない6),7)。化合物結合タンパクについて、味覚器官で発現するものが見つかっており8)、食草の選択に重要な役割を持つものも報告されている9)。ナミアゲハでは、Chemosensory protein (CSP) がゲノムの特定の領域にクラスターしており10)、カイコとシンテニーがある事を確認している(投稿中)。また、多種昆虫から化合物結合タンパクの遺伝子が報告され、情報が蓄積しつつある。
本研究は、主たる食草の産卵刺激物質が明らかにされているナミアゲハを主な材料として用い、メス成虫前脚ふ節に発現する味覚受容体遺伝子及び化合物結合タンパク遺伝子をクローニングし、その機能と特徴の解明を目的として取り組んでいる。
昨年度までの取り組みで、ナミアゲハからメス成虫前脚ふ節に発現の特異性を示す7回膜貫通型タンパク質遺伝子(PxutGr1)を発見し、バキュロウイルス発現系を用いたカルシウムイメージング法により産卵刺激物質の一つであるシネフリンに特異的に応答する受容体である事を解明している。本年度は、PxutGr1が生体内でシネフリンを認識するために働き、産卵行動に関与しているか否かを確認する事を目的として、RNAi法を用いた機能阻害と電気整理実験・産卵行動実験に取り組んだ。
結果と考察
1.電気生理学的手法およびRNAiを用いたPxutG1遺伝子のin vivo機能解析 PxutGr1発現量の変化
PxutGr1遺伝子のdsRNA(二本鎖RNA)を蛹期のメスに注射し、メス成虫ふ節感覚子内に存在する神経細胞の活動電位の電気生理学的記録と産卵行動の観察を行った。
1-1. dsRNA注射による遺伝子発現抑制効果
培養昆虫細胞を用いた実験においては、約400塩基のdsRNAをPxutGr1遺伝子のほぼ全長をカバーする3ヶ所から作成した結果(図1)、いずれの領域も発現を抑制する効果がある事を確認している(2008年度活動報告書)。ナミアゲハ生体内におけるPxutGr1遺伝子の発現量を定量PCRで計測した結果、羽化前日の蛹期に最大になることが明らかになっているので(2007年度活動報告書)、蛹期にdsRNAを注射し抑制効果を調べた。気温25℃の飼育環境下の場合、蛹期は約10日間で安定であるので、本実験では蛹化の翌日を羽化9日前(-day9)と数えている。
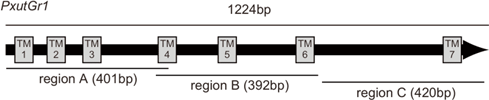 |
| 図1 PxutGr1遺伝子の模式図とdsRNA合成に用いた領域 |
現在までに、Region AとRegion BのdsRNAを注射し、定量PCRによって発現量の低下を確認している(図2)。どちらの領域を注射した場合も抑制効果が確認されるが、Region AとBの比較では、Bでより強い効果が観察された。Region Aを注射した場合、5μgでは発現量の低下に有意差は見られなかったが、10μgでは羽化3日前(-day3)と5日前(-day5)で有為な低下が観察された。Region Bを注射した場合には、5μgでも有為な低下が観察されたが、10?gでは更に強い抑制効果があった。どちらの領域を注射した場合も、発現量が最大となる羽化前日(-day1)では有為な抑制効果が見られず、蛹化後早期に注射した場合に強い抑制効果が見られた(-day3, -day5, -day9)。以上の結果から、蛹化後5日以内にdsRNAを注射する事で強い効果が得られると考えられるが、蛹化後早期の注射では死亡率が若干上がる傾向があるため、蛹化後5日(羽化5日前)が最適な注射時期であると考える。
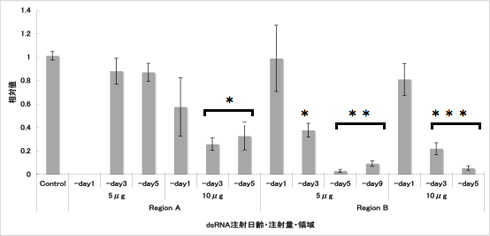 |
| 図2 定量PCRによるPxutGr1遺伝子の発現量比較 |
Contorl(未処理)個体の発現量を1.0とした場合のdsRNA処理個体での発現量の相対値を示した。Region A の5μg(-day1)は測定結果なし。検量線作成のためにrp17s遺伝子を使用した。各値は、平均値±標準誤差を示す。*は各発現量の相対値の多重比較検定を行った結果、有意に差があることを示す(*P<0.01, **P<0.001 ***P<0.0001 Tukey HSD)
1-2.dsRNAを注射したチョウの電気整理実験による活動電位の計測
電気生理学的手法により、dsRNAを羽化5日前に注射したメス成虫のふ節感覚子のシネフリン特異的応答低下を確認した(Region A, Bそれぞれ5μgまたは10μg)。電気生理実験は九州大学理学研究院谷村禎一准教授の研究室で行った。羽化後0~2日齢のメス成虫の前脚ふ節を転節と腿節の接合部分からカッターで切除し、不関電極およびリンガー液で満たされたガラス管を切断部から挿入した後、実験台に固定した。固定したふ節の感覚子に刺激電極および刺激物質の水溶液で満たしたガラス管をあて、感覚子内の神経細胞における応答(活動電位の発生および発生頻度)を測定した。メス成虫のふ節感覚子は第5節だけでも60~70本存在し、本数にも場所にも個体差があるため、ふ節第5節から10~20本の感覚子を無作為に選び、5秒間の記録測定を行った。その結果、dsRNA注射個体のふ節感覚子でシネフリン特異的に応答が低下することが判明した(図3, 4)。シネフリンに応答する感覚子の割合は、Region Aを5μg注射した個体を除いて有意に減少した(図3)。さらに、応答が確認された感覚子の5秒間のスパイク数(活動電位の発生頻度)も、dsRNAを注射した個体で有意に減少した。標準刺激物質として使用したスタキドリンに対する応答は、コントロール個体とdsRNA個体で同じであった。また、超純水のみを注射した個体のシネフリン応答はコントロール個体と同じであった。以上の結果は、dsRNAの注射でPxutGr1遺伝子の発現が抑制されたことにより、シネフリン特異的に感覚子の応答が低下したことを示し、PxutGr1遺伝子が生体内でシネフリン受容体として機能していると考えられる。
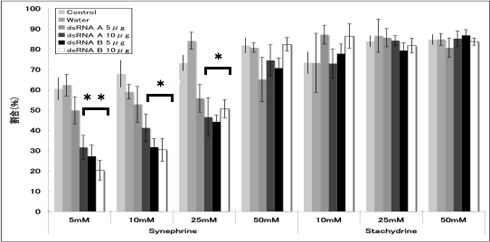 |
| 図3 シネフリン・スタキドリンに応答する感覚子の割合 |
割合は「応答した感覚子数÷ふ節1本あたり刺激した感覚子の総数×100」で算出した。各値は、平均値±標準誤差を示す(ふ節サンプル数=6-28)。*は各割合値の多重比較検定を行った結果、有意に差があることを示す(*P<0.05, **P<0.01 Tukey HSD)
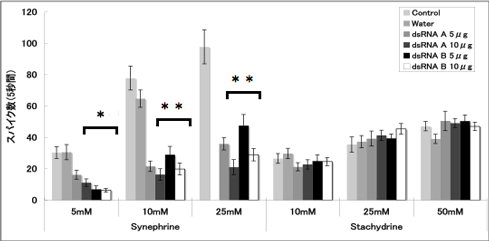 |
| 図4 シネフリン・スタキドリンに応答する感覚子の応答頻度(スパイク数) |
各値は、平均値±標準誤差を示す(感覚子サンプル数=15-70)。*は各スパイク数の多重比較検定を行った結果、有意に差があることを示す(*P<0.01,**P<0.0001 Tukey HSD)
1-3.dsRNAを注射したチョウの産卵実験
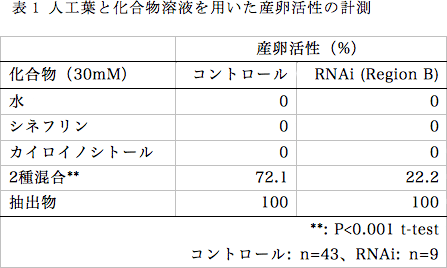
ナミアゲハの産卵刺激物質は10種類報告されているが、シネフリンとカイロイノシトール2種類の組み合わせで約70%の産卵活性があり、どちらか1種類のみでは全く産卵行動を示さない事が報告されている11)。RNAiによってPxutGr1の発現を抑制した場合、シネフリン・カイロイノシトールの混合溶液に対する産卵活性が低下する事が期待される。電気整理実験と同様に、羽化5日前の蛹にRegion BのdsRNAを10μg注射し、羽化したメス成虫の産卵実験を行った。餌を与えてから1時間後に照明を開始する事で、その1時間後に産卵活性が高まる事を発見したので、実験容器中で自由飛翔をするメス成虫に人工葉を提示して産卵行動を観察した。
dsRNAを注射したメス成虫もミカン葉抽出物を塗布した人工葉、またはミカン科植物生葉には産卵行動を示すが、シネフリン・カイロイノシトール混合溶液に対する産卵活性の低下が観察された(表1)。混合溶液に産卵したRNAi個体についても、水またはシネフリン・カイロイノシトール単独の溶液には産卵活性を示さなかった。これらの事から、dsRNAの注射でPxutGr1の発現が抑制されたことにより、シネフリンに対する応答が低下したと考えられる。
以上の結果から、ナミアゲハから見つかったPxutGr1遺伝子は、産卵刺激物質の一つであるシネフリンを特異的に認識する化学受容体の遺伝子であり、産卵行動に関与している事が示唆される。 鱗翅目昆虫ではRNAiの効果が得られにくい事が知られており、研究者間の国際的な情報交換を目的とした研究グループが立ち上げられるといった活動があるほど困難である事が知られている。本研究では、味覚受容体遺伝子PxutGr1に的を絞り、その特性を詳細に調べる事で発現の抑制に成功し、電気整理実験および行動実験で変化を観察できた事は大きな成果であるといえる。
2.ナミアゲハふ節感覚子機能の解析
ふ節感覚子の数は雌雄で異なり、オス成虫で10本程度、メス成虫で約60本程である。しかし、感覚子数の雌雄間差異が味覚認識に与える影響や、各感覚子が認識する産卵刺激物質などの基礎的知見は皆無に等しい。特定のふ節感覚子がショ糖に応答することが電気生理学的研究により最近報告されたが12)、ショ糖に応答する感覚子は数本である。大多数のふ節感覚子は産卵刺激物質の受容に特化した機能を持っている可能性が考えられるが、全感覚子の機能に関する系統だった解析はなされていない。ナミアゲハふ節感覚子の機能解析が進展しない理由は、ふ節感覚子の本数および分布が個体間で異なるため、各感覚子の識別が困難である事にあると考えられる。しかし、メス成虫ふ節感覚子を詳細に観察すると、長さが異なる2種類の感覚子が存在する(図5、Long-type: L-type、Short-type: S-type)。感覚子の形態の違いは感覚子機能の系統的解析において有効な指標となる。キイロショウジョウバエ(Drosophila melanogaster)には3種類の唇弁味覚感覚子が存在し、機能が異なることが知られている13)。そこで、電気生理学的手法を用いて10種類の産卵刺激物質、水、糖、塩に対する応答を測定し、L-typeとS-typeの応答性に違いを調べた(表2)。
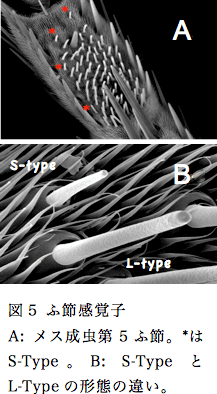
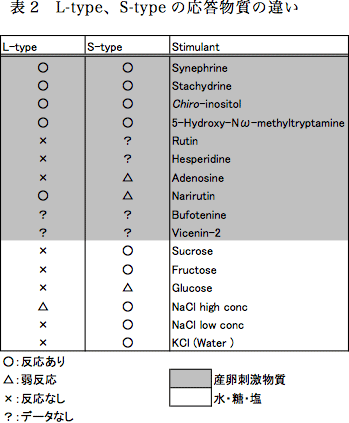
産卵刺激物質の中で水溶性化合物である5種類(Synephrine、Stachydrine、Chiro-Inositol、5-Hydroxy-Nω-methyltryptamine、Naritutin)はL-type、S-typeともに応答を示した。AdenosineはS-typeのみ反応が見られた。難水溶性であるRutinやHesperidineはL-typeでの応答は確認できなかった。BufotenineおよびVicenin-2は海外で製造されているが輸出入禁止などの理由から購入できないため使用していない。次に水(KCl)・糖・塩(NaCl)に対する応答を調べた結果、これらの刺激物質にはS-typeのみで応答することが明らかとなった。これらの結果からL-typeは産卵刺激物質の受容特異的な機能を持つ感覚子であり、S-typeは水・糖・塩といった味覚受容に関わりさらに産卵刺激物質も受容できる多機能性感覚子であると考えられる。しかし、S-type感覚子はメス成虫の第5ふ節の感覚子中に3本ほどしかなく、1本もないふ節も存在した。今後、ふ節全体でのS-typeの本数を調べる必要があると考えている。Rutin、Hesperidineは難水溶性化合物であるため、応答を確認することができなかった。そこで、グルコースの糖転移により水溶性に変化させたα-glycosyl-Rutin (Hesperidine)を用いてL-typeでの応答の確認する予定である。また、S-typeのみで応答が確認できたAdenosineやGlucoseに対する応答頻度(スパイク数)は水の応答頻度と変わらないため、これらの物質にはほとんど応答していないことが予想される(データ未記載)。
今後、高濃度の溶液で刺激した際、スパイク数が増加するかを確認する必要がある。今後、さらにオス成虫のふ節感覚子の応答測定、感覚子中の神経細胞数を調べ、系統的機能解析を進める予定である。
3.ショウジョウバエGr5aのカルシウムイメージング
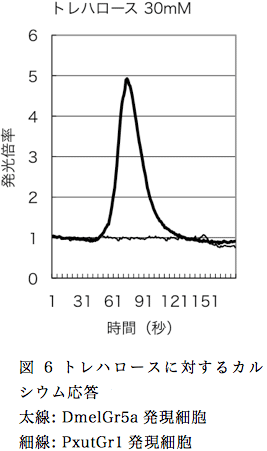
PxutGr1のリガンドについて、カルシウムイメージング法を用いてシネフリンである事を昨年度に報告しているが、独自に構築した実験系であるためリガンドが既知の受容体を用いて確認の実験を行った。昆虫味覚受容体としてリガンドが特定されているショウジョウバエGr5a(DmelGr5a)をエントリーベクターに組み込み、PxutGr1と同様に組み換えバキュロウイスルを構築した。Sf9細胞にウイルスを感染させ、90時間後にトレハロースで刺激を行った結果、DmelGr5aを発現させた細胞では応答が観察されたが、PxutGr1を発現させた細胞では無反応であった(図6)。この結果は、本研究で用いているカルシウムイメージング法の実験系は、正常に機能している事を示している。DmelGr5aのトレハロースに対する発光倍率(30mMで約5倍前後)がPxutGr1のシネフリンに対する発光倍率(30mMで約35倍前後)に比べて低い理由について、現時点で理由は不明である。
おわりに
今年度は、電気生理学的実験や産卵実験によるin vivoでの遺伝子機能解析に取り組み、産卵刺激物質受容システムのメカニズムを解明する事でゲノムの情報と生態の情報を有機的に結びつけ、生命現象をより深く理解するという目標に向けた大きな一歩を踏み出したといえる。鱗翅目昆虫のナミアゲハでRNAiによる遺伝子発現の抑制に成功し、電気生理学的応答や行動の変化が観察できた事は注目に値する。鱗翅目昆虫を研究材料として用いている他機関の研究に、寄与するものがあると思われる。
謝辞
本研究を遂行するにあたり、九州大学理学研究院谷村禎一准教授、井下強博士、谷村研究室の学生の皆さん、本研究室卒業生の山田歩さんにご助力をいただいた。石元 広志博士とDelphine Calas博士には、ふ節の電子顕微鏡写真を提供して頂いた。
参考文献
1 Thompson J. N. (1988) Evolutionary genetics of oviposition preference in swallowtail butterflies. Evolution 42: 1223-1234.
2 Nishida R, Ohsugi T, Kokubo S, and Fukami H. (1987) Oviposition stimulants of a Citrus-feeding swallowtail butterfly, Papilio xuthus L. Experientia 43:342-344.
3 Feeny, P. (1995) Ecological opportunism and chemical constraints on the host associations of swallowtail butterflies, pp. 9-15 in J. M. Scriber, Y. Tsubaki, and R. C. Lederhouse (eds.). Swallowtail Butterflies: Their Ecology and Evolutionary Biology. Scientific Publishers, Gainesville, Florida.
4 Tanimura, T., Isono, K., Takamura, T., and Shimada, I. (1982). Genetic dimorphism in the taste sensitivity to trehalose in Drosophila melanogaster. J. Comp. Physiol. 141, 433-437.
5 Clyne PJ, Warr CG, Carlson JR. (2000) Candidate taste receptors in Drosophila. Science. 287:1830-1834.
6 Chyb, S., Dahanukar, A., Wickens, A., and Carlson, J.R. (2003). Drosophila Gr5a encodes a taste receptor tuned to trehalose. Proc. Natl. Acad. Sci. USA 100 (Suppl 2), 14526-14530.
7 Jones, W. D., Cayirlioglu, P., Kadow, I. G. and Vosshall, L. B. (2007) Two chemosensory receptors together mediate carbon dioxide detection in Drosophila nature. 445: 86-90
8 Galindo K, Smith DP. (2001) A large family of divergent Drosophila odorant-binding proteins expressed in gustatory and olfactory sensilla. Genetics. 159:1059-1072.
9 Matsuo T, Sugaya S, Yasukawa J, Aigaki T, Fuyama Y. 2007. Odorant-binding proteins OBP57d and OBP57e affect taste perception and host-plant preference in Drosophila sechellia. PLoS Biol, 5: e118.
10 Ohsugi, T., Nishida, R., & Fukami, H., Multi-Component System of Oviposition Stimulants for a Rutaceae-Feeding Swallowtail Butterfly, Papilio xuthus (Lepidoptera: Papilionidae). Appli. Ent. Zool. 26 (1), 29-40 (1991).
11 Ozaki K., Utoguchi A., Yamada A. and Yoshikawa H. (2008) Identification and genomic structure of chemosensory proteins (CSP) and odorant binding proteins (OBP) genes expressed in foreleg tarsi of the swallowtail butterfly Papilio xuthus. Insect Biochem. Mol. Biol., 38: 969-976
12 Inoue T.A., Asaoka K., Seta K., Imada D. and Ozaki M. (2009) Sugar receptor response of the food-canal taste sensilla in a nectar-feeding swallowtail butterfly, Papilio xuthus. Naturewissenschaften 96: 355-363
13 Hiroi M., Marion-Poll F. and Tanimura T. (2002) Differentiated response to sugars among labellar chemosensilla in Drosophila. Zool. Sci. 19, 1009-1018.
