年度別活動報告
年度別活動報告書:2006年度
アゲハチョウの食草選択と進化
尾崎克久(研究員) 中秀司(奨励研究員)
廣崎由利恵(研究補助員) 山田歩(大阪大学大学院生)
宇戸口愛(大阪大学大学院生) 吉川寛(非常勤顧問)
はじめに
昆虫は生活史の中で、環境の情報を知る手段として化合物を巧みに利用している。化合物の受容は味覚・嗅覚として認識され、寄主選択、配偶行動、集団生活の維持、社会性の構築など様々な場面で重要な役割を担っている。寄主選択において化学受容の仕組みに変化が生じた場合、それまでとは異なる空間を生息の場として利用する集団が現れ、住み分けが何世代にもわたって繰り返されることによって種分化へとつながる。このような変化は、進化の歴史を物語る証拠としてゲノムに刻まれる。昆虫と環境との関わりにおいて中心的な機能である味覚や嗅覚といった化学受容に関わる分子機構の解明は、昆虫の多様化、種分化、適応の仕組みを解明するために、最も有力な手がかりになると考えられる。
植物は自らの生命維持には直結しない、様々な化合物を体内で生産している(二次代謝物質)。二次代謝物質の組み合わせは植物種ごとに異なっており、植食性昆虫にとっては食草を識別するための重要な手がかりとなっている。アゲハチョウの仲間は、他の多くの植食性昆虫と同様に、特定の植物のみを餌として利用する単食性に近い寄主選択をしており、寄主選択とアゲハチョウ科の進化には相関関係が認められる1)。卵から孵化したばかりのアゲハチョウの幼虫は、体が小さく移動能力が低いため、自力で餌を探索することは困難である。メス成虫による正確な植物種の識別と産卵場所の選択は、次世代の生存を左右する重要な役割である。メス成虫は産卵の直前に前脚で葉に触れることで含有する化合物を感じ取り、その組み合わせによって産卵行動が引き起こされる。ナミアゲハ(Papilio xuthus)では、ウンシュウミカンの葉から産卵刺激物質として10種類の化合物が単離されている2)。それらは、主としてフラボノイド、アミン類、糖の誘導体に分類される。他にも数種のアゲハ類で産卵刺激物質が明らかにされており、これらの構造についてアゲハ種間で比較すると類似性が認められる。植物の系統的近縁性とは無関係に、植物に含まれている化合物の類似性が寄主転換の可能性を支え、食性の進化を可能にしたのではないかと考えられている3)。これまでに報告されている産卵刺激物質は全て不揮発性であるため、「味」のようなものとして認識していると考えられている。前脚での味の感じ方に変化が生じた場合、それまでとは異なる植物を選択する集団が現れて、住み分けによる隔離を出発点とする同所的種分化という現象を引き起こしたと考えられる。
産卵刺激物質を認識する前脚ふ節には、化学感覚毛と呼ばれる特殊な器官が多数存在する。化学感覚毛の構造はショウジョウバエの典型的な味覚組織にある感覚子と類似していることから、ショウジョウバエの味覚感覚子と同様に味覚レセプターを発現し、産卵刺激物質を受容していることが考えられる。ミカン科食性のアゲハチョウ間であっても、種ごとに産卵刺激物質として認識する化合物の組み合わせが異なるため、種ごとに特徴的な多様な味覚レセプターを持っていることが予測される。また、味覚レセプターが化合物を認識するためには、化合物が化学感覚毛内のリンパ液を通り抜けてレセプターに到達する必要があるため、化合物を結合して運搬する役割を持つタンパクが必要になると考えられる。味覚レセプターと化合物結合タンパクを中心とする産卵刺激物質受容システムに関わる遺伝子群を解明し、複数種間で比較することができれば、食草転換を原動力として起きた進化という現象のメカニズムを理解する重要な手がかりになると考えた。
昆虫の味覚に関する研究が本格的に始まったのは20年以上前に遡るが4)、味覚レセプターは2000年になって初めて7回膜貫通Gタンパク質共役型レセプター(以下GPCRと略)が報告された5)。化学受容のGPCRは一次構造の多様性が高く、脊椎動物から報告されている味覚・嗅覚のGPCRに対する類似性を手がかりとした探索は困難であり、ショウジョウバエの全ゲノム配列の情報科学的解析によって候補遺伝子ファミリーが同定された。昆虫の味覚レセプターは極端に発現量が少ないため解析は困難を極め、直接的な証拠によって機能が解明されているものはまだ少ない6),7)。化合物結合タンパクについて、味覚での機能に関する報告はまだないものの、味覚器官で発現するものが見つかっている8)。また、多種昆虫から化合物結合タンパクの遺伝子が報告され、情報が蓄積しつつある。
本研究は、主たる食草の産卵刺激物質が明らかにされているナミアゲハとシロオビアゲハを材料として用い、メス成虫前脚ふ節に発現する味覚レセプター遺伝子及び化合物結合タンパク遺伝子をクローニングし、その機能と特徴の解明を目的として取り組んでいる。初年度(2001年)はナミアゲハメス成虫前脚ふ節からcDNAライブラリーを調製し、大量塩基配列決定方法とRT-PCRによる発現部位決定法を確立した。2002年度はナミアゲハメス成虫前脚ふ節cDNAライブラリーの網羅的な塩基配列決定及び、得られた配列の情報解析、発現解析を行った。その結果、ふ節に特異的に発現するGPCRであるPXFT-01989、化学感覚器官に限定的に発現する3種類の化合物結合タンパク(chemosensory protein: CSP)、ふ節で発現する3種のアミンレセプター及び1種類のチトクロームp450の遺伝子をクローニングした9)。2003年度はFosmidベクターを用いてナミアゲハゲノムライブラリーを作製し、既に得られた上記候補遺伝子をプローブとして、ゲノム上の遺伝子の全構造と関連遺伝子ファミリーのクローニングを行った。2004年度は、ふ節に特異的に発現するGPCR遺伝子であるPXFT-01989から、選択的スプライシングによって少なくとも4種類のメッセンジャーRNAが作られていることを発見した。また、PXFT-01989遺伝子を手がかりとして、他のアゲハチョウからGPCR遺伝子を探索した結果、シロオビアゲハから類似性の高い部分配列を発見した。複数のGPCR遺伝子の発見を目的として、シロオビアゲハのメス成虫ふ節の完全長cDNAライブラリーを作成した。2005年度は、バキュロウイルスベクターを用いて培養昆虫細胞中でPXFT-01989遺伝子を発現させ、カルシウムイメージング法を用いて化合物への応答について解析を行い、PXFT-01989遺伝子が産卵刺激物質の一つであるしネフリンのレセプターである可能性を示唆する結果を得た。また、シロオビアゲハのcDNAライブラリーの解析で見つかったCSPファミリーについてナミアゲハと比較することでこの遺伝子ファミリーの進化について考察した。
本年度は、PXFT-01989遺伝子の化合物との結合をより詳細に調査すると同時に、産卵活性への関与について、解明を試みた。
GPCRの系統解析
ナミアゲハのGPCR遺伝子、PXFT-01989が昆虫の味覚レセプターのグループに属するか確認するため、ショウジョウバエから見つかっている味覚GPCRと嗅覚GPCR、そして鱗翅目昆虫から見つかっている化学レセプターのアミノ酸配列を用い、系統解析を行った(図1)。遺伝距離の算出には最尤法を用い、アライメントから可変領域を推定し、アミノ酸置換率を4カテゴリーに分けて値を算出した。遺伝距離の算出の際、アミノ酸置換モデルは赤池情報量基準(AIC)に基づいてWAGを選択した。樹型の構築には近隣結合法を用いている。この結果、昆虫の化学レセプターは味覚グループと嗅覚グループに大別されることが明らかになった。外群として用いた数種のロドプシンタイプGPCRは全て、化学レセプターとは完全に異なるグループであることを示した。タバコガの一種 Heliothis virescens から見つかった21種類の化学レセプターのうち、3種類が味覚グループに属し、残りの18種類が嗅覚グループに属することが示唆された。カイコから見つかった7種類の化学レセプターは、全て嗅覚グループに属することが示唆された。ナミアゲハのGPCRであるPXFT-01989は、PSI-BLASTによって類似性が示唆された Heliothis virescens Chemoreseptor 4 とショウジョウバエの味覚レセプターGr43aに近い枝となり、味覚グループに属することが示された。この結果から、PXFT-01989は味覚レセプターであると考えられることから、PxutGr1と呼ぶことにした。
結果と考察
PxutGr1 Synephrine応答の濃度依存性
カルシウムイメージング法を用いた解析により、ナミアゲハのGPCR遺伝子であるPxutGr1が、Synephrine(シネフリン)に特異的に反応するレセプターである可能性が高いことを昨年度報告しているが、PxutGr1を発現させていない細胞でも内在性のOctopamine(オクトパミン)レセプターの影響と思われる弱い発光が観察されている。PxutGr1を発現させた場合と発現させていない場合の発光強度の違いが、有為なものであるか調べるため刺激溶液の濃度の違いによる影響を調査した(図2)。Synephrine溶液を300mM、30mM、3mM、0.3mM、0.03mM、0.003mMの濃度で用意し、最終濃度が1/3になる量を培養細胞を入れたディッシュに流し込んで刺激を行った。PxutGr1とAequorinを発現させた細胞と、Aequorinのみを発現させた細胞それぞれに対し各濃度毎に5反復の実験を行い、t検定で有意差を求めた。その結果、0.01mM以下の濃度ではどちらの細胞でも発光は観察されなかったが、0.1mM以上の濃度では両方の細胞で発光が観察された。刺激による発光のベースラインに対する倍率は、発光が観察された全ての濃度でAequorinのみを発現させた細胞よりPxutGr1とAequorinを発現させた細胞で高かった。発光強度は、PxutGr1とAequorinを発現させた細胞では1mMで限界に達し、10mMでは1mMと同等であったが、100mMでは低下することが観察された。Aequorinのみを発現させた細胞では、10mMで発光が最大になり、100mMで低下することが観察された。PxutGr1とAequorinを発現させた細胞とAequorinのみを発現させた細胞の発光強度の違いは、0.1mM、1mM、10mMでは0.1%水準で有意差があり、100mMでは5%水準で有意差があることが示された(図2A)。Octopamineでも同様の実験を行ったが、全ての濃度でPxutGr1とAequorinを発現させた細胞とAequorinのみを発現させた細胞間の有為な差は観察されなかった(図2B)。この結果から、PxutGr1とAequorinを発現させた細胞で観察されるSynephrineで刺激した際の強い発光は、PxutGr1がSynephrineを受容したことにより細胞内のカルシウム濃度を大幅に上昇させたためであると考えられる。
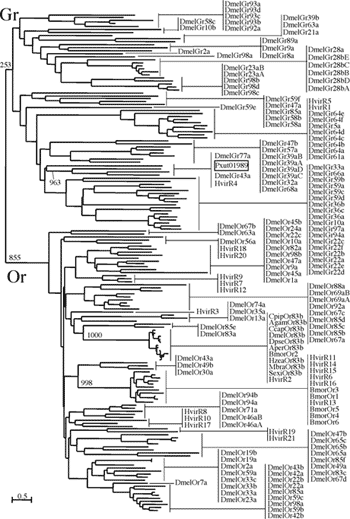 |
図1. ショウジョウバエと鱗翅目昆虫の化学受容GPCR の系統解析
化学受容GPCRは味覚と嗅覚の2グループに大別される。外群として用いたショウジョウバエのロドプシンタイプGPCRは省略した。ナミアゲハGPCRであるPXFT-01989は、PSI-BLAST解析で相同性が示されたHvirR4とDmelGr43aと共に味覚グループに属している。
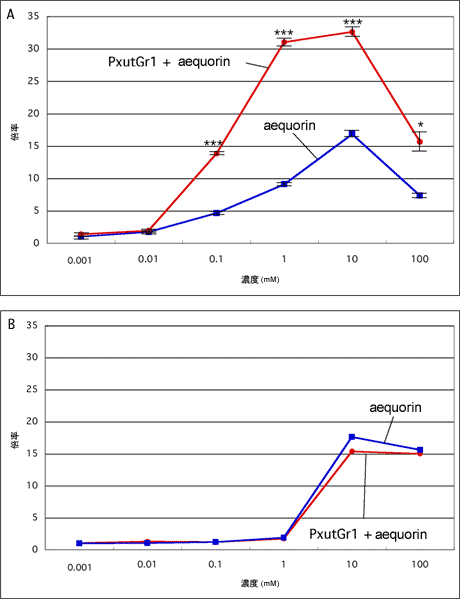 |
| 図2. 化合物の刺激による濃度依存曲線 各濃度でそれぞれの細胞に対して5反復ずつ試験を行い、t検定による解析を行った。A: Synephrineでの刺激。***は0.1%水準での有意差。*は5%水準での有意差。PxutGr1とAequorinを発現させた細胞では、1mMで発光強度がビークに達したが、Aequorinのみを発現させた細胞では10mMがピークになった。どちらの細胞も、100mMでは発光が弱くなる。B: Octopamineでの刺激。発現させた遺伝子による有意差は無かった。 |
RNAiによるPxutGr1の不活性化
ナミアゲハの産卵刺激物質SynephrineのレセプターであるPxutGr1が、産卵活性に関与するか調査するため、RNAiを施した場合の電気生理的応答の変化を調べた(図3)。RNAiとは、不活性化したい遺伝子の配列を持つ二本鎖RNAを与えることによって、遺伝子の活性を大幅に低下させる技術である。PxutGr1の完全長配列を持つ二本鎖RNAを合成し、生理食塩水に溶解した20μgまたは40μgの二本鎖RNAを羽化前約24時間の蛹に注射により導入した。羽化後約24時間の成虫から前脚ほぼ全体を切り取り、感覚毛を個別に化合物溶液で刺激し、4秒間の活動電位を記録した。その結果、ナミアゲハ雌成虫ふ節感覚毛のSynephrineに対する応答の大幅な低下が観察された。5mMのSynephrine溶液で刺激を行った場合、活動電位を発する感覚毛の数が有為に減少した。また、50mMで刺激を行った場合、統計的有意差は出なかったものの5mMと同様に活動電位を発する感覚毛の数が減少する傾向が観察された。Stachydrine(スタキドリン)での刺激に対しては、活動電位を発する感覚毛の数の減少は観察されなかった。以上の結果から、PxutGr1の二本鎖RNAの影響により、ナミアゲハ雌成虫ふ節感覚毛のSynephrineに対する応答が低下したと考えられ、PxutGr1が産卵活性に関与する可能性が示唆される。本研究は、鱗翅目昆虫では成功例が少なく、非常に困難であると考えられていたRNAiの貴重な成功例であると思われる。
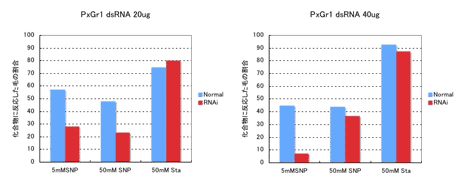 |
図3. RNAiを施した場合の化合物への応答の影響
dsRNAを導入した事により、Synephrineの刺激に対して応答する感覚毛の割合が低下した。5mMの濃度では有意差が観察された。*は5%水準での有意差、**は1%水準での有意差。
成虫成熟に伴うPxutGr1の発現変化
2004年度に、PxutGr1のショートタイプを3種類発見し、ひとつの遺伝子から少なくとも4種類のmRNAが合成されていることを報告した。今回、PxutGr1の発現パターンが、成虫の成熟に伴って変化している可能性を示す結果が得られた(図4)。雌一個体分のふ節(2本)からRNAを抽出し、トータルRNA2μgを逆転写してFirst strand cDNAを合成し、PCRのテンプレートとして用いた。その結果、羽化前1日または羽化後1日の成熟が進んでいない場合はノーマルタイプの発現量が多く、ショートタイプの発現量が少ないのに対し、羽化後4日まで成熟が進んだ場合はノーマルタイプの発現量が減少し、ショートタイプの発現量が増加してノーマルタイプとショートタイプがほぼ同等になっていることが観察された。この結果は、ナミアゲハの雌成虫は、羽化直後に後尾は可能であるが、羽化後3日目から産卵し始めるという現象と、産卵刺激物質レセプターの発現パターンの変化に関連がある可能性を示唆するものであると考えられる。
 |
図4. 成虫成熟にともなう発現の変化
M: サイズマーカー(1Kbp)、-1: 羽化前1日、+1: 羽化後1日、+4: 羽化後4日。
おわりに
カルシウムイメージング法を用いた解析により、PxutGr1がSynephrineに反応して細胞内のカルシウム濃度を大幅に上昇させていることが明らかになった。Sf9には内在性のOctopamineレセプターが存在し、Synephrineにも反応することが知られているため、Synephrineに対する応答がPxutGr1の発現によりSf9が新規に獲得した機能であるとは言えないながら、PxutGr1のリガンドがSynephrineであることが証明できたと考える。内在性Octopamineレセプターの影響が無い条件での実験が可能であれば、より確実な証拠となると思われる。
RNAi処理を施した個体の前脚では、Synephrineに反応する感覚毛の数が有為に減少したことから、PxutGr1はSynephrineレセプターとして産卵行動を引き起こす神経伝達に関与していることが示唆された。鱗翅目昆虫では困難であると考えられていたRNAiによる遺伝子サイレンシングが、アゲハチョウで可能であることが示唆されたことから、分子生物学的手法で得られた情報と、生体機能をリンクさせる研究の道が開けたと考えている。
PxutGr1の発現パターンの変化と、雌成虫の産卵行動に関連性が示唆された結果は、今後の研究の進展にとって興味深いと思われる。成虫が成熟し、産卵が可能になる時期と、選択的スプライシングによる発現パターンの変化に何らかの関連があった場合、選択的スプライシングという現象が存在する意義を考える上でも重要な発見となる可能性がある。来年度はショートタイプの機能解析に重点的に取り組みたい。
謝辞
九州大学の谷村禎一助教授、石本広志博士、France National Institute for Agricultural ResearchのFrederic Marion-Poll教授、Delphine Calas博士には本研究遂行にあたり多大な御助力をいただいた。
参考文献
1 Thompson J. N. (1988) Evolutionary genetics of oviposition preference in swallowtail butterflies. Evolution 42: 1223-1234.
2 Nishida R, Ohsugi T, Kokubo S, and Fukami H. (1987) Oviposition stimulants of a Citrus-feeding swallowtail butterfly, Papilio xuthus L. Experientia 43:342-344.
3 Feeny, P. (1995) Ecological opportunism and chemical constraints on the host associations of swallowtail butterflies, pp. 9-15. in J. M. Scriber, Y. Tsubaki, and R. C. Lederhouse (eds.). Swallowtail Butterflies: Their Ecology and Evolutionary Biology. Scientific Publishers, Gainesville, Florida.
4 Tanimura, T., Isono, K., Takamura, T., and Shimada, I. (1982). Genetic dimorphism in the taste sensitivity to trehalose in Drosophila melanogaster. J. Comp. Physiol. 141, 433-437.
5 Clyne PJ, Warr CG, Carlson JR. (2000) Candidate taste receptors in Drosophila. Science. 287:1830-1834.
6 Chyb, S., Dahanukar, A., Wickens, A., and Carlson, J.R. (2003). Drosophila Gr5a encodes a taste receptor tuned to trehalose. Proc. Natl. Acad. Sci. USA 100 (Suppl 2), 14526-14530.
7 Jones, W. D., Cayirlioglu, P., Kadow, I. G. and Vosshall, L. B. (2007) Two chemosensory receptors together mediate carbon dioxide detection in Drosophila nature. 445: 86-90
8 Galindo K, Smith DP. (2001) A large family of divergent Drosophila odorant-binding proteins expressed in gustatory and olfactory sensilla. Genetics. 159:1059-1072.
9 Ono H., Ozaki K. and Yoshikawa H. (2005) Identification of cytochrome P450 and glutathione-S-transferase genes preferentially expressed in chemosensory organs of the swallowtail butterfly, Papilio xuthus L. Insect Biochem. Mol. Biol., 35: 837-846.
