RESEARCH
年を刻む冬眠物質
私たち哺乳類は、体温がほぼ一定の恒温動物です。体温が30℃程度まで下がると、ヒトはたちまち低温傷害を起こして短時間で凍死します。ところが、外気温と同程度まで体温が下がっても傷害を起こさない哺乳類がいます。例えば、シマリスです。寒くて食べ物が少ない厳しい冬を、彼らは冬眠という省エネ状態で乗り越えます。
冬眠中、彼らの心臓の拍動や呼吸は極度に抑えられ、代謝は通常の50分の1以下になります。外見は凍死している状態と変わりませんが、がらりと変わった体内のしくみで、ゆったりと生命の営みを進めているのです。彼らの体は、どのようにして冬眠状態へと変わっていくのでしょうか。
近藤宣昭さんは、冬眠中の心臓が通常とは異なる動作原理で働いていることを見つけました。そこから、冬眠のしくみ解明への長い挑戦が始まりました。

1.欠点と利点が交錯する低体温
哺乳類は体温が37℃付近でほぼ一定に保たれる恒温動物であり、そこから大きく外れると、組織や細胞が致命的な傷害を受ける。細胞を構成する成分、特にタンパク質が働く最適な温度範囲が狭いのである。ところで、低体温には利点がある。代謝が下がるので摂取する食物の量が少なくて済み、感染症やガンなどの進行性の疾患や不慮の事故による外傷の悪化を抑えることができるのである。さらには、老化を遅らせる効果があるとも言われている。もし、体温を自在に下げることができれば、食料や健康に関わる問題を解決できるかもしれない。けれども実際には、ヒトの場合、体温が30℃程度まで下がると、低温傷害を起こして短時間で凍死してしまう。
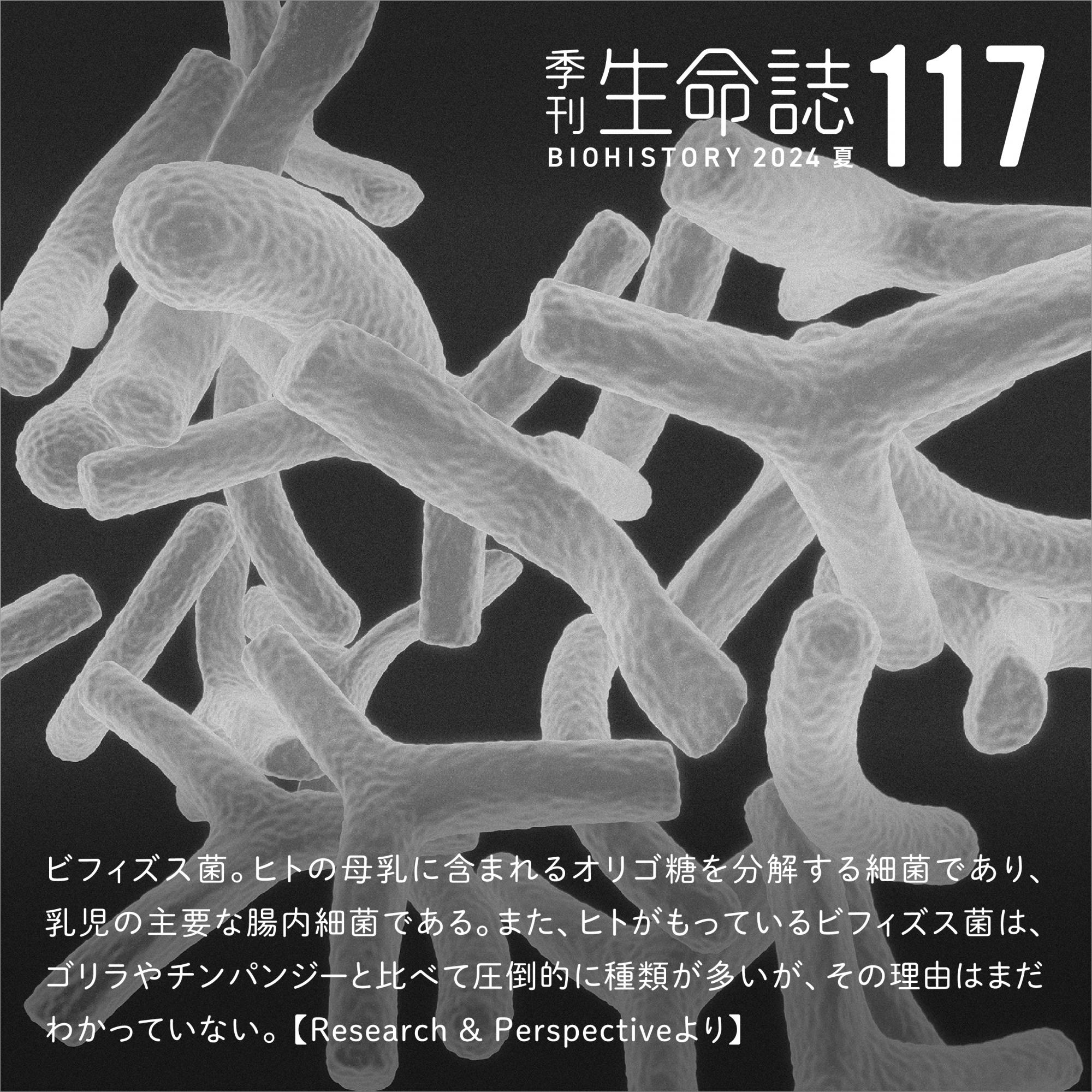
実は、哺乳類の中にも0℃近くまで体温が下がっても何の傷害も起こさず、冬の数ヶ月間を冬眠状態を繰り返しながら過ごす種がいる(図1)。
(図1) 体温の変化
赤外線サーモグラフィーを使って、シマリスの体の表面の温度を記録した(上図)。気温が下がると、約25℃あった体表面の温度は約5℃まで低下した。そして彼らは、ときどき目を覚ましながら約5 ヶ月間の深い眠りについた(下図)。
例えば冬眠中のシマリス(齧歯目、リス科)では、心臓の拍動や呼吸が極度に抑えられ、代謝は活動時の1/50以下にまで低下し、外見上は凍死と何ら変わらない状態となる(図2)。しかし、体内では生命の営みがゆったりと進行しているのである。同じ哺乳類なのにこの違いはどこから来るのだろう。冬眠のしくみが解明されれば、ヒトに応用できるかもしれない。20世紀初頭から、世界の研究者が躍起になって取り組んできた課題である。

(図2) 生理的パラメーターの変化
活動中は高かったシマリスの心拍数や代謝速度は(左)、冬眠によって低い値へと変わる(右)。
2.冬眠中の心臓から見えてきたこと
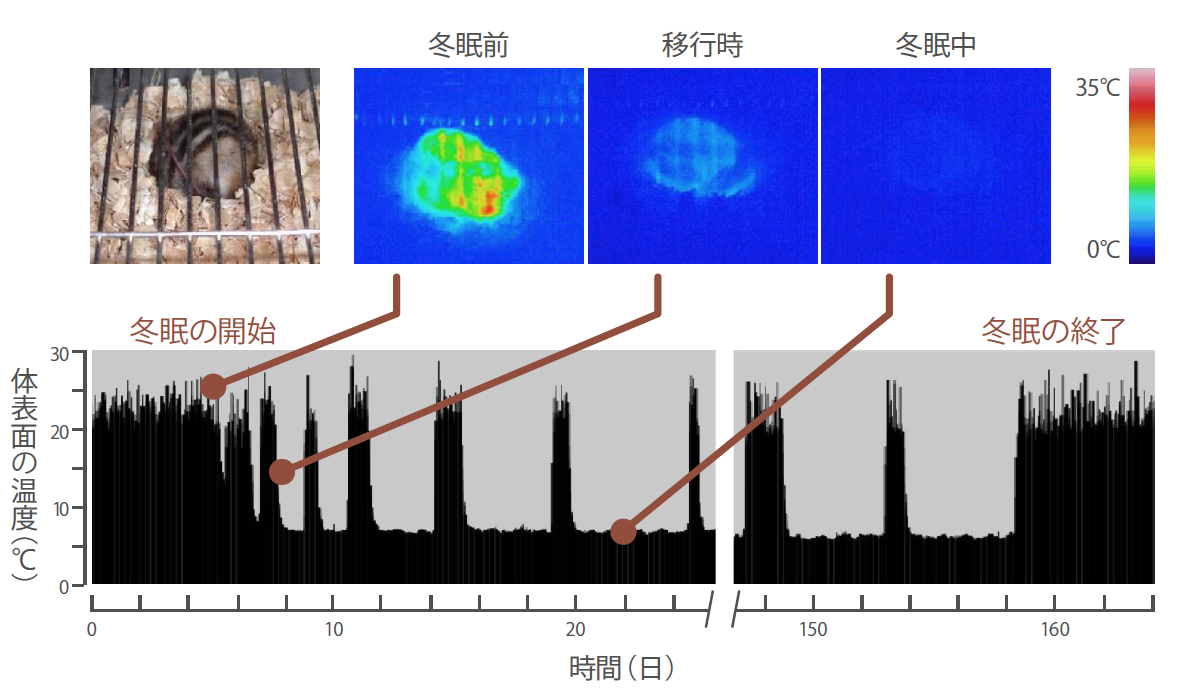
20℃まで温度が下がると収縮できなくなる心臓の低温保存の研究をしていた私は、0℃近い体温でも働き続ける冬眠動物の心臓に関心をもった。そこでシマリスで、夏期と冬眠中の個体から心筋を取り出してその働きを比較したところ、信じられないような現象が見つかった。夏期の心筋細胞では、細胞外に多量に存在するカルシウム(Ca)イオンがチャネルを通して細胞内に流入し、それが収縮繊維に結合した結果、心臓が収縮する(図3)。一方、冬眠中にはこのチャネルの機能が抑制されており、Caイオンは細胞内へ殆ど流入していなかった。当然、収縮は起こらないだろうと思った。ところが、驚くべきことに心臓は強く収縮していたのである。この意外な結果を解明していったところ、冬眠中の細胞内では、Caイオン供給源である筋小胞体(註1)から遊離したCaイオンが直接、収縮を起こしていた。低温では通常、チャンネルの開閉機能がバランスを失い、大量のCaイオンが細胞内に流れ込んでしまう。ところが、冬眠中はチャンネルとは無関係に細胞内のCaイオン濃度が調整され、維持されていたのである。これは、これまで全く知られていなかったしくみである。しかも、筋小胞体の機能が異常に増強されるという予想外の変化も起きていた。そのうえこの現象は、冬眠動物だけの特殊なしくみによるものではなく、すべての哺乳類の心筋にそなわっている機能を調整したものであることもわかった。つまり、ヒトでも同様の性質を獲得する可能性があるということである。
(図3) 心筋細胞の変化
心臓の心筋細胞は、普段は細胞内外でカルシウムイオン(Ca2+)をやりとりして収縮する(左)。いっぽう冬眠中のシマリスでは、細胞中の筋小砲体に蓄えられたCa2+で収縮する(右)。細胞外へのCa2+の排出はNa-Ca交換機構も関与する。
(註1) 筋小胞体
筋細胞にある膜系の構造体。カルシウムイオンの取込みや放出を担い、筋の弛緩と収縮を制御している。
3.血中を巡る冬眠特異的タンパク質
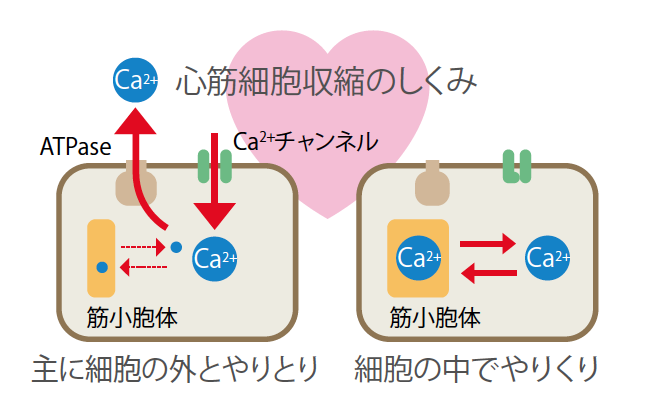
次の展開は、年間を通して23℃、12時間の明暗周期で飼育しているシマリスが見せてくれた。温暖環境下なので冬眠できないにもかかわらず、暦での冬期になると心臓が冬眠様になるのである。これは、体内で年周期のリズムが作られているということであり、体内リズムに連なって変化する因子の存在を予想させた。血中にその因子を探したところ、予想どおりのタンパク質複合体が存在した。これまで知られていない3種類のタンパク質からなるヘテロ三量体(註2)と、それに結合したタンパク質分解酵素阻害因子とからなる冬眠特異的タンパク質(Hibernation specific protein: HP)複合体である。質量は140kDaで、肝臓から血中に分泌されていた。ところが驚いたことに、冬眠中にはこの複合体の発現が抑制され、血中濃度が激減していたのである(図4)。そして、冬期にHPの血中濃度が減少する個体しか冬眠しなかった。他のリス科の動物を調べたところ、冬眠する種ではHP遺伝子が発現していたが、冬眠しない種ではHP遺伝子のエクソン領域(註3)の一部に読み枠のズレや、転写調節領域(註4)の破損があり発現していなかった。HPが冬眠への移行に必須であることを指示する事実である。それなら、HPが増加している部位があるはずだ、それは血中の物質が自由に拡散できないバリアーで仕切られた部位に違いないと考えた。
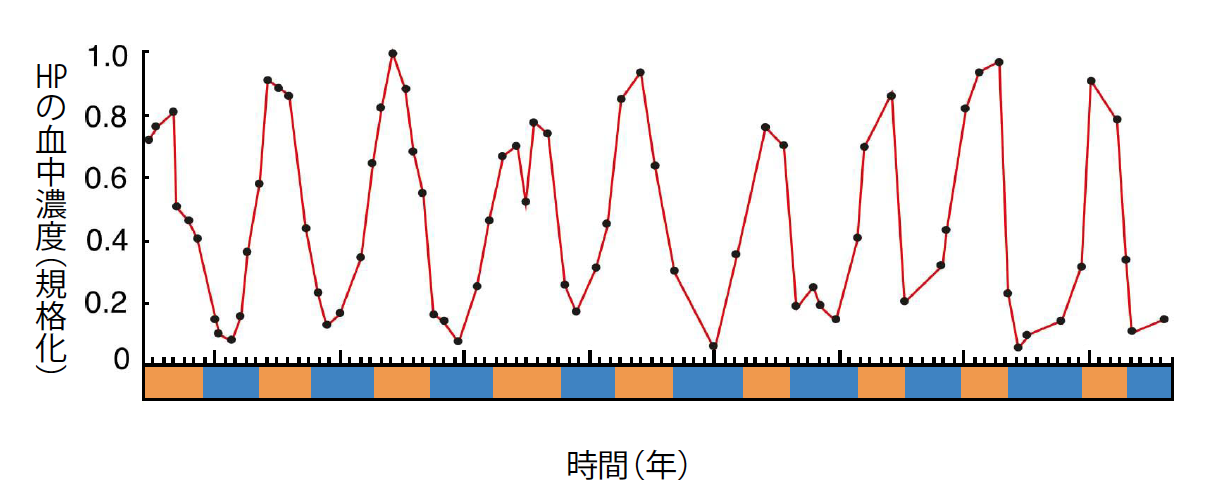
(図4) HPの濃度変化
シマリスの血中にある冬眠特異的タンパク質(HP)は、年周期のリズムで変わる。ただし活動中に量が多くなり、冬眠中は10分の1以下にまで下がる。
(註2) へテロ三量体
異なる分子あるいはサブユニットが3種類集まって出来た物質。冬眠特異的タンパク質複合体の場合は、20、25、27kDaのタンパク質がらせん構造を形成している。
(註3) エクソン領域
DNAの塩基配列の中で、mRNAとして残る部分。ちなみに、除かれる部分はイントロンと呼ばれる。エクソンには、タンパク質に翻訳される部分とそうでない部分が含まれる。
(註4) 転写調節領域
転写開始の足場となるプロモーター領域、転写量を調節するエンハンサ-領域、転写を抑制するサイレンサー領域からなる部分。
4.血中から脳内への移行
脳から採取した脳脊髄液(註5)中にHP複合体を検出したのは、1990年代の中頃だった(図5)。非冬眠時期は、HP複合体が血中にマイクロモーラー(μM)のオーダーで多量に存在するが、脳内ではその1/1000以下と微量だった。それが冬眠時期になると、血中濃度の低下に逆行して脳内濃度が増加し、冬眠が最も深くなる中期には非冬眠時期の50倍近くにも達していた。
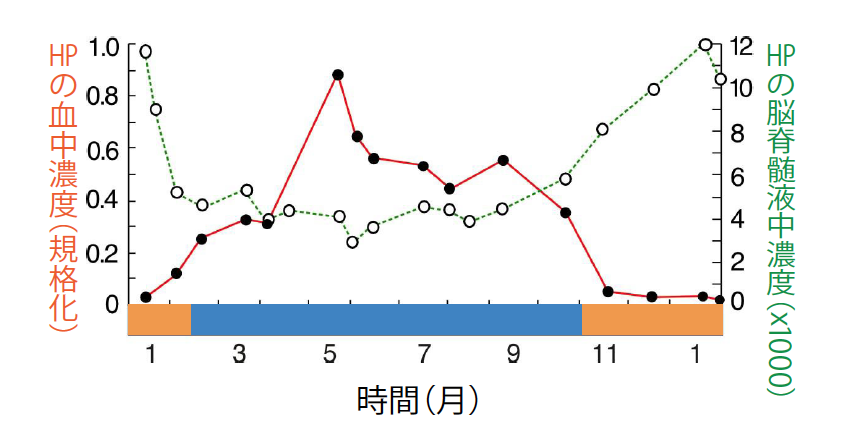
(図5) 血中と脳脊髄液中での濃度変化
シマリスの血中にあるHPの濃度は、冬眠中に下がる(黒丸の線)。それとは対称的に、脳脊髄液中のHPの濃度は、冬眠中に高くなる(白丸の線)。
脳内へのHPの輸送は、血液脳脊髄液関門(註6)である脈絡叢(註7)を介して能動的に起こっていた(図6)。関門を通過したHP複合体からはタンパク質分解酵素阻害因子が解離し(図7)、HPが活性化していた。HPが脳内で機能していることを裏付けるために、HP複合体の働きを阻害する抗体を冬眠中の脳内に長期的に投与したところ、期待どおり、抗体濃度に依存して冬眠が著しく抑制された。投与によって冬眠を中断させることもできた。冬眠後期に抗体を投与すると、脳内でのHPの減少が加速され、冬眠は早々に終了した。非冬眠期にはHP複合体が血中に十分量常備され、生存が危機に瀕する厳寒の時期には最も重要な器官である脳で活性化されていたのである(図8)。自然の中で育まれた見事な摂理が、突然姿を見せてくれるのが実験の面白さだと実感した。
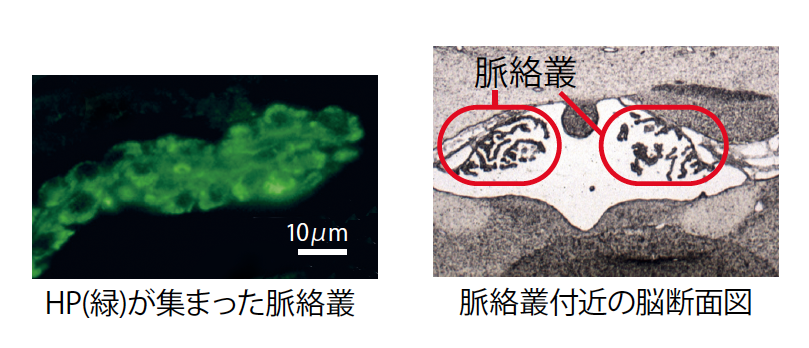
(図6) 脈絡叢に集まったHP
血中で減少したHPの行方を追ったところ、脳脊髄液を作り出す脈絡叢(みゃくらくそう)に能動的に運ばれていた。
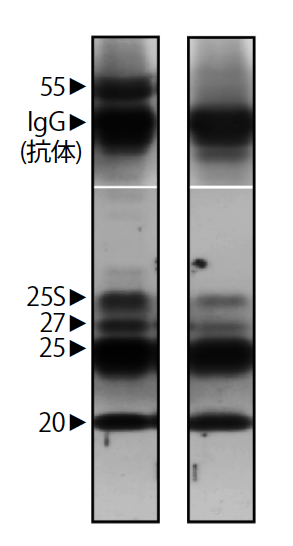
(図7) HP複合体の変化
血中のHP複合体は、20、25、27kDaの3種類のタンパク質とそれに結合する55kDaのタンパク質分解酵素阻害因子からなる(左)。いっぽう脳内に運ばれたHP複合体は、タンパク質分解酵素阻害因子が外れていた(右)。25Sは糖鎖が付いた25kDaのタンパク質を示す。
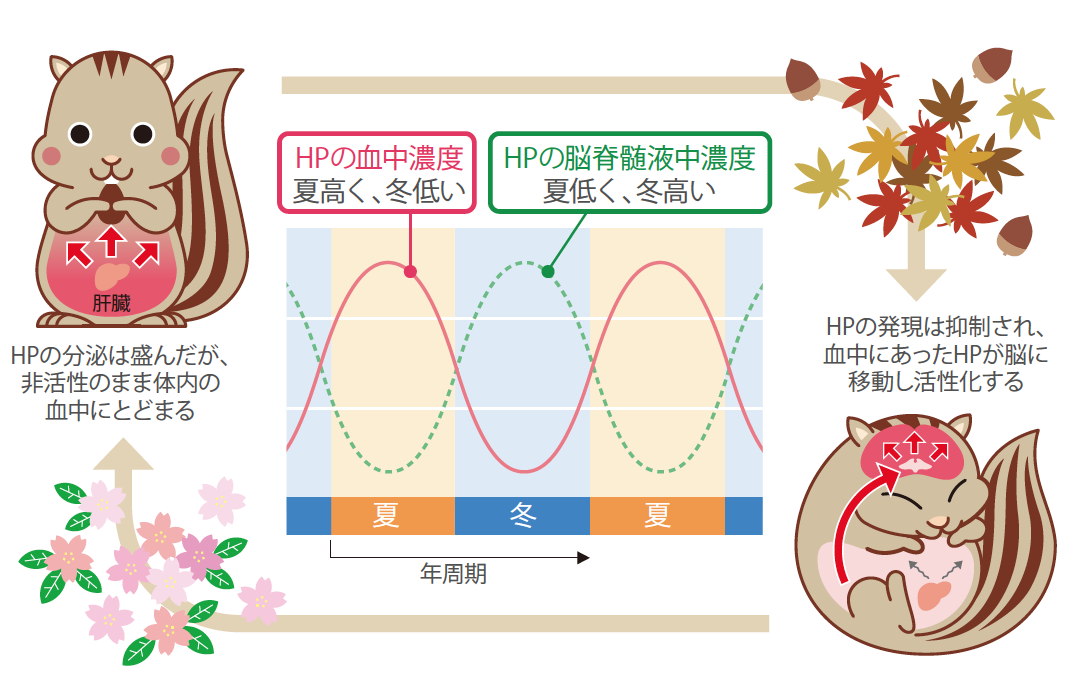
(図8) HPの体内分布の変化
活動中のシマリスでは、肝臓で作り出されたHPは血液に乗って体中をめぐる(左)。いっぽう冬眠中は、脈絡叢を通して脳内に輸送され、脳脊髄液に乗って脳全体に運ばれる。
(註5) 脳脊髄液
脈絡叢で産生され、クモ膜下腔と脳室系を満たす無色透明の液体。
(註6) 血液脳脊髄液関門
血液と脳脊髄液間の物質の出入りを制限する機構。
(註7) 脈絡叢
脳脊髄液を産生している、脳室にある血管が発達した組織。
5.生体システム全体を見る大切さ
1990年代以降、冬眠中に発現が増加する遺伝子の探索が続けられてきたが、HP遺伝子以外に冬眠に特異的なものは見出されていない。発現差があるとされている遺伝子やタンパク質についても、その調節や制御、冬眠との関係は殆ど分かっていない。発現の差を見るだけでは、冬眠中に血中で濃度が低下し、脳内に輸送されるタンパク質など想像すらできなかっただろう。この方法ではHPは見つからないのである。私の場合、冬眠という生体現象をシステム全体として追ったからこそHPに辿り着いた。全体を見る視点だからこそ、見かけの現象や個別の解析からは想像できない本質にアプローチできたのである。今、自信をもってそう言うことができる。これまでに得た結果は、冬眠が先天的な特性ではなく、後天的に調節された変化によって実現していることを示している。つまり、生体のしくみの調整で、ヒトも健康で長寿な体に変えることができると考えられる。冬眠研究は、単なる体温低下やそれに耐える現象の解明にとどまらず、生理分子システムの理解へと展開しようとしている。
図1、4、5、6、7は、N.Kondo, et al., Cell, 125, 161-172 (2006) より改変

近藤宣昭(こんどう のりあき)
1978年東京大学大学院薬学系研究科博士課程修了。薬学博士。
三菱化学生命科学研究所主任研究員、(財)神奈川科学技術アカデミーを経て、玉川大学学術研究所特別研究員。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)
.jpg)
.jpg)