RESEARCH
ホヤの光受容タンパク質から眼の進化を追う
視覚を司る感覚器である眼に注目してみると、私たち脊椎動物が持つカメラ眼や無脊椎動物である昆虫が持つ複眼など、構造や形態が大きく異なっていることがわかる。私たちは全ての動物の眼に共通して存在する光受容体タンパク質であるオプシンに眼を向け、そこから眼の進化を探っている。
1.光受容タンパク質オプシン
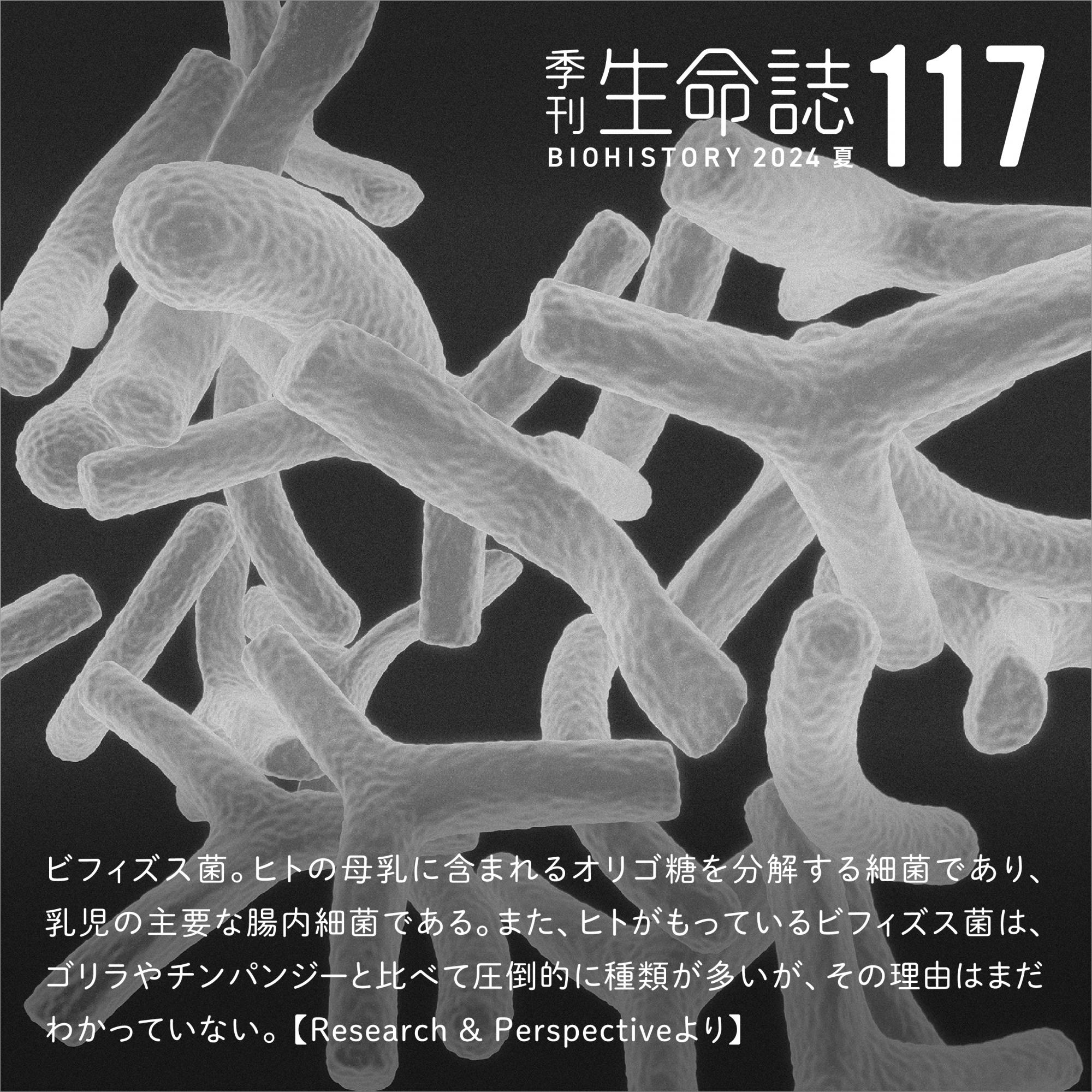
視覚機能を支えているのは、オプシンと呼ばれる光受容タンパク質である。眼の網膜に存在する視細胞に高密度で存在し、眼の中で最初に光を受けるという重要な役割を担っている。オプシンは、ビタミンAの誘導体であるレチナールを保持しており、レチナールはオプシン中の特定のリジン残基と共有結合(シッフ塩基結合)を形成している(図1)。レチナールは本来、私たちの眼には見えない紫外線しか吸収できないため、オプシンは単にレチナールを結合するだけでは可視光は吸収できない。しかし、分子進化の過程でオプシン中にカウンターイオン(対イオン)と呼ばれる特別なグルタミン酸残基を獲得し、それがレチナールと相互作用することで、可視光の吸収が可能となった。
(図1) オプシンとカウンターイオン
オプシン中のカウンターイオンとレチナールの相互作用で可視光の吸収が可能となる。カウンターイオンがないとオプシンの吸収波長のピークは紫外光の領域にあるが(紫)、カウンターイオンを獲得すると、吸収波長のピークは可視光の領域へとシフトする(緑)。
2.オプシンの活性化とシグナル伝達
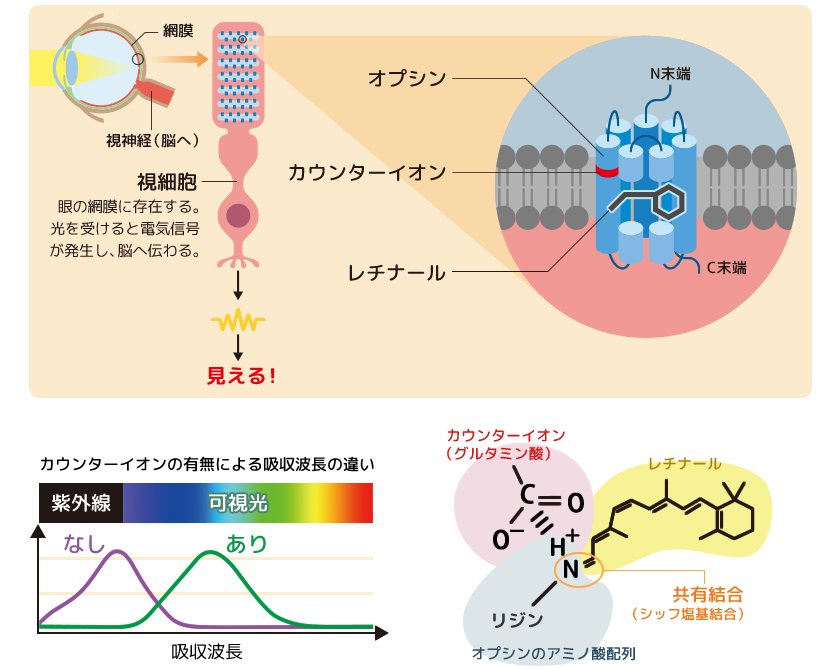
光を受けていない不活性状態のオプシンに結合しているのは、シス型のレチナールであり、視細胞に到達した光の受容によって、11-シス型から全トランス型へとレチナールの光異性化(シス-トランス異性化)が起こる(図2)。レチナールの構造変化に伴ってオプシンの構造変化が引き起こされ、活性状態となったオプシンは、視細胞内に存在する3量体Gタンパク質と共役して情報を伝達する。活性化したGタンパク質のGDP-GTP交換反応を介して視細胞内のシグナル情報伝達系が駆動し、そこで生じた電気信号が脳へと伝わって私たちは”見えた”と感じるのだ。
(図2) オプシンの活性化とシグナル伝達経路
3.オプシンから見る脊椎動物と無脊椎動物の違い
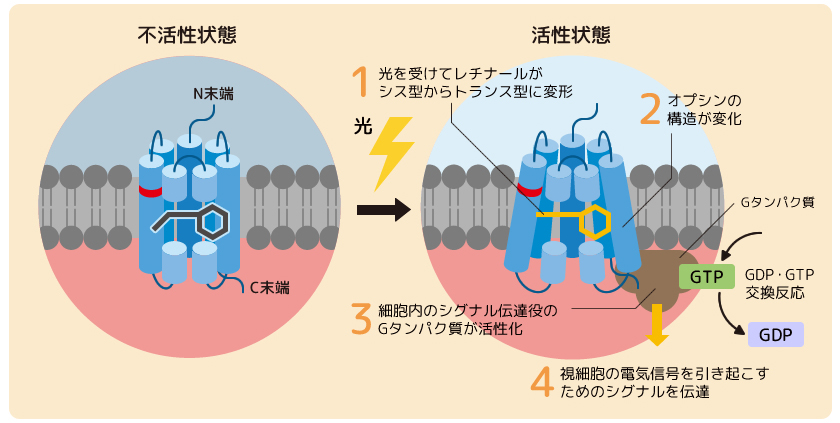
脊椎動物の眼は、暗がりでも明所でもものを正確に見ることができるように、高い光感受性を持つことが知られている。このような視覚機能がどのようにして生み出されてきたのかを明らかにすべく、脊椎動物型と無脊椎動物型のオプシンの性質の比較が長年行われてきた(図3)。
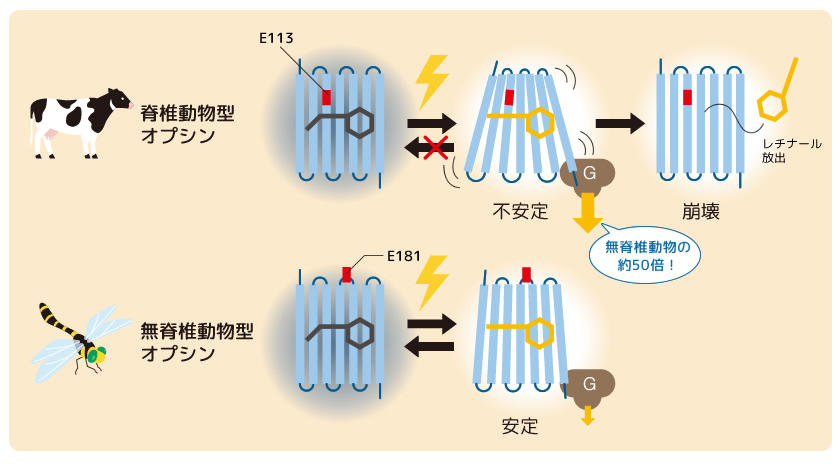
(図3) 脊椎動物と無脊椎動物のオプシンの特徴
上:脊椎動物型オプシン。レチナールの光異性化に伴って形成された活性状態は不安定だが、Gタンパク質のシグナル増幅効率が高い。
下:無脊椎動物型オプシン。レチナールの光異性化に伴って形成された活性状態は安定であり、光を受けると再び元の状態に戻る性質を示す。
(図3) 脊椎動物型オプシンが光を受けて反応する様子:動画
元々は赤い色をしているオプシンが、光を受けることで活性状態を形成する。時間経過に伴ってレチナールを放出することで活性状態が崩壊し、退色していく。
オプシンの光受容にはレチナールと相互作用するカウンターイオンであるグルタミン酸残基(E)の存在が欠かせない。そこで、このカウンターイオンの位置を脊椎動物型と無脊椎動物型オプシンで調べたところ、無脊椎動物型ではN末端から181番目のグルタミン酸(E181)がカウンターイオンとして機能しているのに対し、脊椎動物型では、N末端から113番目のグルタミン酸(E113)が機能していることが明らかとなった。
次に活性状態の安定性を両者で比較したところ、無脊椎動物型オプシンの活性状態は時間が経っても崩壊せずに安定であり、光を受けると再び元の状態に戻ることがわかった。一方で、脊椎動物型オプシンの活性状態は光を受けても元の状態には戻らず、不安定であるために時間経過とともにレチナールが放出されて活性状態が崩壊することがわかった。つまり、無脊椎動物型オプシンでは、光を浴び続けると活性状態の一部が元の状態に戻ってしまうが、一方で、脊椎動物型オプシンではそのような反応は起こらないため、効率よく活性状態を形成できると考えられた。さらに、オプシンがGタンパク質を活性化する効率(活性化効率)は、脊椎動物型で無脊椎動物型の50倍ほど高いことも明らかとなった。
脊椎動物型オプシンは、分子進化の過程で113番目のグルタミン酸(E113)をカウンターイオンとして獲得したことにより、活性状態の安定性は失いながらも効率よく活性状態を形成する反応を示し、Gタンパク質の活性化効率を大きく上昇させたと考えられる。効率的な活性状態の形成と活性化効率の高度化に伴って、光情報伝達系の増幅効率が上昇し、それが光への高い感受性を持つ脊椎動物の眼の形成につながったのだろう。
4.脊椎動物と無脊椎動物の中間体、ホヤ
私たちは、オプシンの進化の過程を探るために脊椎動物に最も近縁な無脊椎動物であるホヤ(カタユウレイボヤ)に注目した。カタユウレイボヤは、成体では海底に付着しているが、幼生の段階では海中を遊泳する。幼生は、光環境に応じて行動を変化させるのだが、この明暗による行動の変化に眼点の光受容細胞で機能するオプシン(ホヤオプシン1,Ci-opsin1)が関わっていることが知られていた。そこでこのホヤオプシン1を調べたところ、脊椎動物型オプシンと同様に113番目のグルタミン酸(E113)を持ち、これが可視光の吸収に必須であることがわかった(図4)。しかも、ホヤオプシン1では、無脊椎動物型オプシンで可視光の吸収に必須な181番目のグルタミン酸(E181)も同時に機能していたのである。そこで、ホヤオプシン1の活性状態の性質を調べたところ、脊椎動物型オプシンのように活性状態は不安定であり、時間経過とともに活性状態が崩壊するという反応を示した。しかしながら、無脊椎動物型オプシンと同様に、光を受けると再び元の状態に戻ることができるという性質も持ち合わせていた。さらに、Gタンパク質の活性化効率は脊椎動物型と無脊椎動物型の中間的な値を示した。つまりホヤオプシン1は、無脊椎動物型から脊椎動物型へとオプシンのカウンターイオンの位置が移り変わっていく過程を目の当たりにするかのような性質を見せてくれたのである。
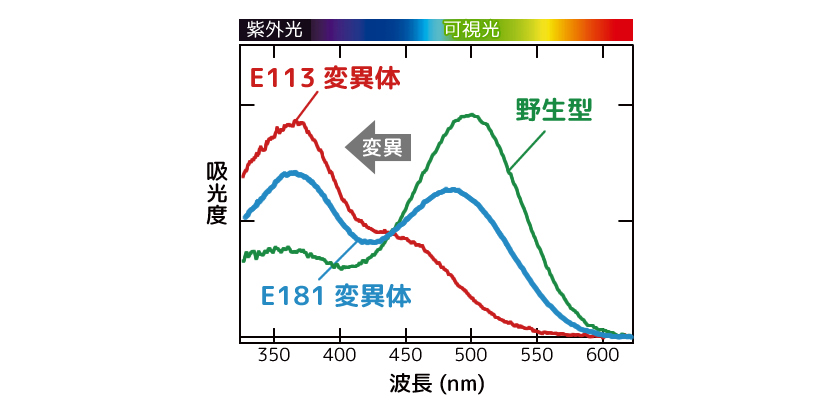
(図4) カウンターイオンの置換に伴う吸収波長の変化
野生型のホヤオプシン1は可視光領域に吸収波長のピークをもつ(緑)。E113を別のアミノ酸に置換したもの(赤)、E181を別のアミノ酸に置換したもの(青)では、波長のピークが紫外光(紫外線と同様)へシフトする。つまり、E113やE181は「可視光を吸収するために重要である」と言える。図は、Kojima et al., (2017) Proc. Nat. Acad. USA. 114, 6028-6033. より改変した。
そこで、ホヤオプシン1の113番目のグルタミン酸(E113)を別のアミノ酸残基に置換した変異体を作製した。すると、このオプシンは、無脊椎動物型オプシンと同様に時間が経っても活性状態を安定に維持していた。一方、181番目のグルタミン酸(E181)を別のアミノ酸残基に置換した場合には、脊椎動物型オプシンと同様に、活性状態は光を受けても元の状態には戻らず、時間経過とともに活性状態が崩壊するという反応を示した(図5)。しかし、この変異体の活性化効率は、脊椎動物型オプシンと同じレベルまでは上昇しなかった。Gタンパク質の活性化効率を上げるには、さらなる進化が必要なのであろう(図6)。ホヤオプシン1は、進化の過程で活性化効率を上げるために必要な新規のグルタミン酸残基を獲得しているが、まだ、脊椎動物型オプシンのように高い活性化効率の獲得には至っていないのである。
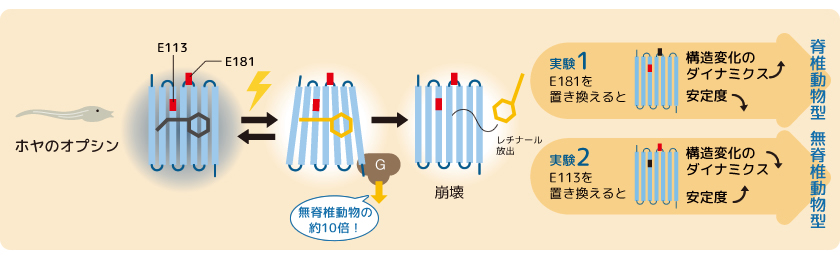
(図5) ホヤオプシン1の実験方法と結果
ホヤオプシン1がもつE113とE181をそれぞれ別のアミノ酸に置換した結果、それぞれ脊椎動物型、無脊椎動物型オプシンと類似した特徴を示した。
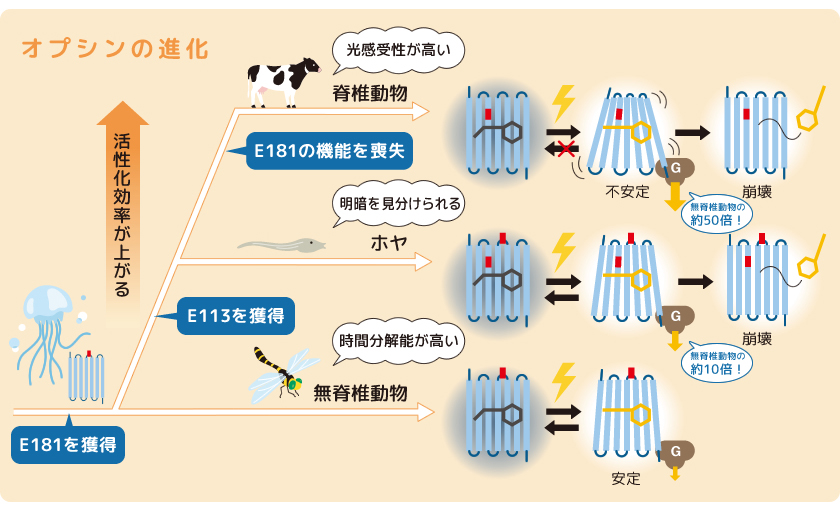
(図6) オプシンの段階的進化
5.ホヤのオプシンから進化の過程を探る
小学生の頃、私たちが見ているのはものそのものではなく、反射された光であるという話を聞き、「光が見えるってどういうこと?」という思いが湧き上がった時の感覚は今も覚えている。大学の4回生で研究室に配属されて以来、私は生きものが光をどのように見て感じているのかという問いへの答えを求めて研究を続けてきた。
ホヤのオプシンが示した脊椎動物と無脊椎動物のオプシンのまさに中間的な性質は、脊椎動物が視覚に利用しているオプシンの分子進化の過程を考える上で重要な手掛かりを与えてくれるに違いない。私たちヒトを含む脊椎動物が持つ高度な視覚機能がどのようにして生み出されてきたのか。その答えを、光を受容するタンパク質であるオプシンの研究を通して追い続けていきたい。

小島 慧一(こじま・けいいち)
2016年京都大学大学院理学研究科生物科学専攻博士課程修了。博士(理学)。日本学術振興会特別研究員などを経て、2017年より岡山大学医歯薬学総合研究科(薬学系)助教。2017年「日本生物物理学会若手奨励賞」受賞。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)

.jpg)
.jpg)