RESEARCH
組み合わせで進化した古細菌のtRNA
全ての生きものがもっているtRNA遺伝子ですが、古細菌の中に少し変わったタイプをもつものが見つかってきています。新しく発見されたtRNA遺伝子は初期の生命がもっていた姿を残しているのではないか、tRNA遺伝子の成り立ちを探るカギがここにありそうです。
1.かっちりとしていなかったtRNA遺伝子
地球上の生きものは多種多様であり、一見、生物が暮らせそうにない100℃近くの温泉や塩湖、深海などの環境にも、古細菌などの単細胞の微生物群が存在していることが最近わかってきた。古細菌とは1990年に提唱されたバクテリアにも真核生物にも属さない第3の生物界で、全生物の共通祖先に近い形質を今も残していると言われている。
DNAの情報がメッセンジャーRNA(mRNA)に転写され、転移RNA(tRNA)(註1)を介した翻訳によってタンパク質ができるという生物共通のしくみは、古細菌にも通用する。このしくみの中でtRNAは、自身がRNA分子でありながら、タンパク質合成に必須なので、初期の生命システムから現在までとぎれることなく存在している分子化石と考えられてきた。ところが、近年の古細菌のゲノム解析により、一部のtRNA遺伝子が大きく異なることがわかってきた。通常、tRNA遺伝子は転写後にすぐ三つ葉の形をしたクローバー葉構造をとるようになっている。ところが、古細菌では、tRNAになる前に切りとられるイントロンという領域があったり、tRNAが2つの断片に分かれて存在したりする (split tRNA)のである(図1)。
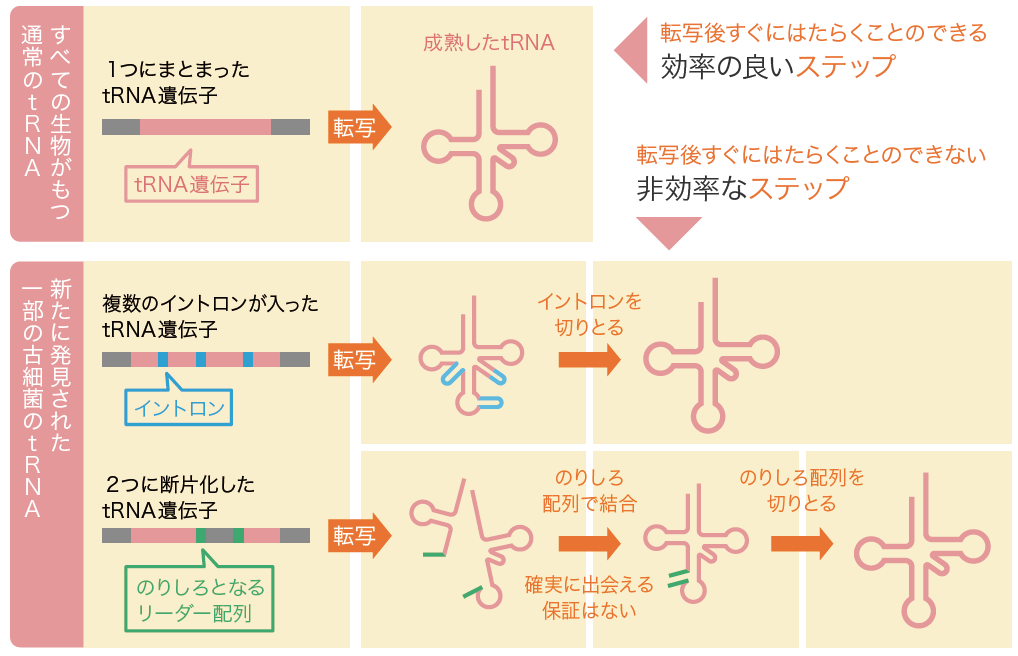
(図1) 通常のtRNA遺伝子と、新たに発見された古細菌のtRNA遺伝子
実は、split tRNAが発見されたナノアーキア(Nanoarchaeum equitans)は他の古細菌に寄生して暮らすので、一般の古細菌よりもゲノムがかなり縮小しており、大規模な再編成が生じた痕跡も残っている。つまり、split tRNAは変わった古細菌に偶然できた遺伝子である可能性も否定できない。私たちはさまざまな古細菌のtRNA遺伝子を調べ、その起源と進化を探ることにした。
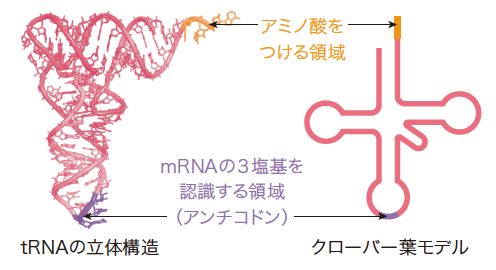
(註1)tRNA
tRNAは、タンパク質をつくる細胞小器官(リボソーム)上でmRNAを3塩基ずつ認識して、対応するアミノ酸を合成中のアミノ酸の鎖につける働きをする。クローバー葉モデルはtRNAを模式的に描いたもの。
2.新たなtRNA遺伝子を探す
最初の関門はtRNA遺伝子の探索方法である。従来のソフトウェアは一般的なひとつながりのtRNA遺伝子の探索を想定しているため、断片化したtRNA遺伝子を予測できない。そこで、私たちは独自にゲノムの異なる領域をつなぎあわせてtRNA遺伝子を探す「SPLITS」(註2)というソフトウェアを開発した。まず、46種あるはずのtRNA遺伝子の一部が見つかっていない古細菌を数種選び出し、ゲノムの中に隠れているtRNA遺伝子を洗い出した。すると、イントロンを複数持つようなtRNA遺伝子が見つかってきたが、断片化したsplit tRNA遺伝子は1つも見つからなかった。やはりナノアーキアのsplit tRNAは寄生性の古細菌だからこその特別な形なのだろうかという思いも頭をよぎったが、さらに多くの古細菌のゲノムを解析した。その過程で、2007年末にゲノムの塩基配列が公開されたカルディヴィルガ(註3)という超好熱好酸性古細菌では、グリシンに対応する全3種(CCC/TCC/GCC)、アラニンに対応する2種(CGC/TGC)グルタミン酸に対応する1種(TTC)の計6種のアンチコドンを含むtRNA遺伝子が未発見であることがわかった。これほど多種のtRNAが見つからなかった例はsplit tRNA遺伝子をもつナノアーキア以外では初めてのことなので、新しいsplit tRNA発見へ期待が一気に高まった。
SPLITSを使うと、予想通り、グリシンのtRNA遺伝子が1つ、アラニンのtRNA遺伝子が2つ、グルタミン酸のtRNA遺伝子1つの合計4つがsplit tRNA遺伝子として見つかった。ところが、グリシンに対応する残り2つのtRNAがどうしても見つからない。そこで、カルディヴィルガの近縁種のtRNA遺伝子を断片化し、その配列を用いて検索したところ、カルディヴィルガのゲノムからグリシンのtRNAの前半3分の1とそっくりな配列が見つかった。実はこのtRNA遺伝子の後半部分は先の解析でsplit tRNAとして発見されていたので、前半の3分の1と後半の配列の間をつなぐような、アンチコドンを含む第3の断片があるはずだと考えた。
そこで一工夫し、前半の3分の1をコードするtRNA遺伝子断片の、のりしろとなるリーダー配列に対して相補的な配列を加えて検索すると、カルディヴィルガのゲノムに候補となる配列が2つあることがわかった。驚いたことに、それはわずか12塩基のtRNA配列であり、両側にはのりしろとなるリーダー配列がついていたのである。こうして小さな第3の断片が発見できた。tRNA遺伝子が3つに分かれていた上に、こんなに短い配列だったので、なかなか見つからなかったのも当然だ。私たちは今回発見したグリシンのtRNA遺伝子を"3つに分かれている"という意味で「Tri-split tRNA」と名付けた。
これで、カルディヴィルガからは全部で10のtRNA遺伝子断片が見つかった。ところが、これだけでは6種のtRNA遺伝子をつくるには、足りないのである。どうやって機能するtRNAを作り出しているのだろうか。遺伝子断片どうしの結合を確かめるシミュレーションを行うと、tRNAの前半や後半の断片を共有し 、アンチコドンを含む残りの断片を組み換えて異なるtRNAをつくっていることが明らかになった(図2)。まさに遺伝子のジグソーパズルである。
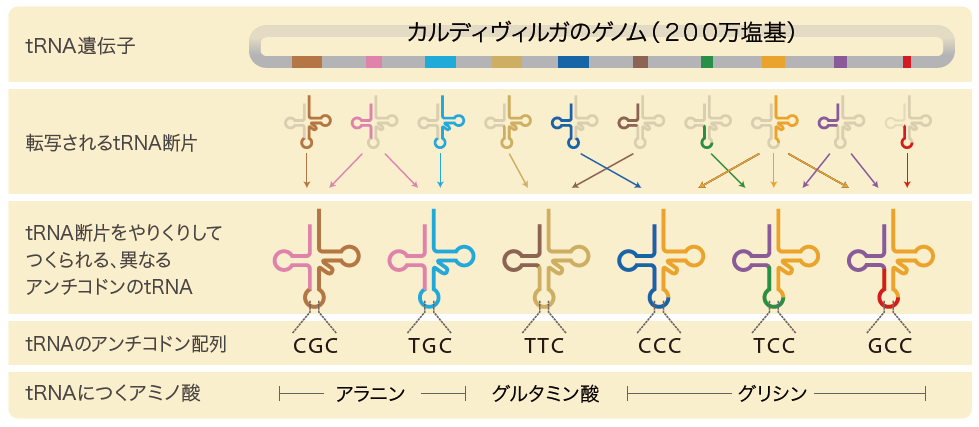
(図2)カルディヴィルガのゲノム上に見つかった10のtRNA遺伝子断片
tRNA遺伝子断片をやりくりして異なるアンチコドンのtRNAをつくることが分かった。
(註2)SPLITS(Spliced tRNA-gene Search)
断片化されたsplit tRNAや複数のイントロンを持つtRNAを予測するためのソフトウェア。菅原潤一氏(慶應義塾大学先端生命科学研究所)が開発した。

(註3) カルディヴィルガ
学名はCaldivirga maquilingensis。ラテン語でcaldiは熱い、virgaは棒という意味をもつ。1996年にフィリピンのマキリン火山の泥温泉から伊藤隆氏(理化学研究所)が単離した桿状の嫌気従属栄養性の古細菌である。至適生育温度が85℃、至適pHが3.7-4.2と、超好熱と好酸性の特徴を併せ持つ。遺伝子数は約2,000個、ゲノム全長は約200万塩基と独立栄養の古細菌としては標準的で、系統樹上の深い位置から分岐しているサーモプロテウス目に属している。
3.はたらくことのできるtRNAなのか
ここまではシミュレーションで進めてきたが、2つや3つに断片化されたtRNA遺伝子が細胞内で本当にはたらいてtRNAをつくっているのかということを確かめる必要がある。まず、tRNA断片が細胞内で存在することを確認し(図3)、それぞれの断片の塩基配列を解読すると、今回発見した10のtRNA断片が全て存在することがわかった。さらに、10のtRNA遺伝子断片の組み合わせでできあがる6種類の成熟tRNAが細胞内に実在することもわかった。Tri-split tRNAに関しては3つの断片のうち2つがつながった2種類の中間体が細胞内に実在することが実験で証明できた(図4)。Tri-split tRNAを作り上げるための明確な順序はなく、3つに分かれた断片が偶然に出会った順にくっついていくようである。
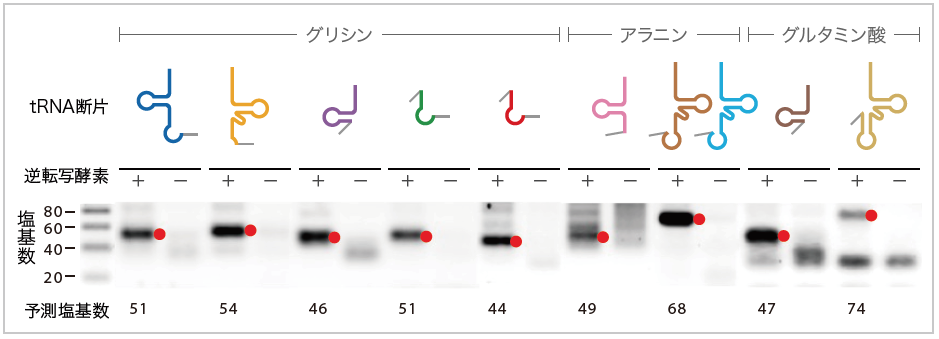
(図3) 細胞内に存在するtRNA断片
RNAからDNAへと逆転写する酵素を加えた時のみ10種のtRNA遺伝子断片が増幅し、予想される塩基数の位置に黒いバンド(●)を確認することができた。tRNA断片に付加しているグレーの線はリーダー配列を示す。
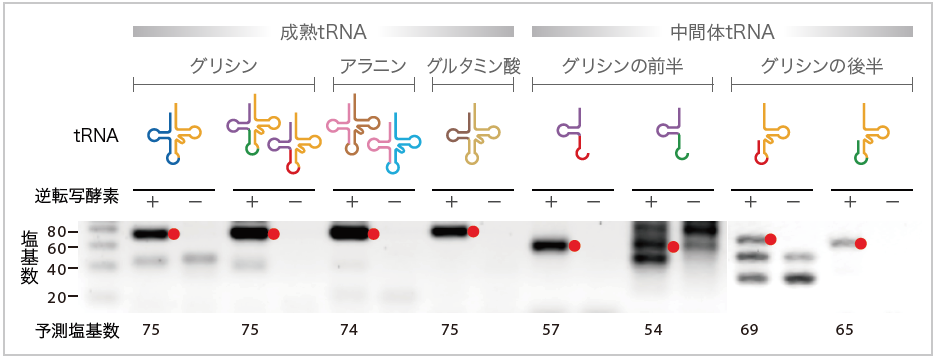
(図4)細胞内に存在する成熟したtRNAと中間体のtRNA
RNAからDNAへと逆転写する酵素を加えて、tRNA断片がくっついて成熟したtRNAや中間体のtRNAになるかを調べ、予想される塩基数の位置に黒いバンド(●)を確認することができた。
残る問題は断片どうしがつながったtRNA分子がタンパク質の合成に使われているかどうかである。私たちはカルディヴィルガのtRNAにグリシンを付加する酵素を精製し、グリシンに対応するTri-split tRNAやsplit tRNAと試験管内で反応させたところ、実際tRNAにグリシンが付加することを確認できた。断片の組み合わせから生じたtRNAはタンパク質合成に用いることができる形になっていたのである。
4.tRNA遺伝子の原型を考える
細胞内で2つや3つに分かれたtRNAの断片は必ず出会えるという保証はなく、いくつかのtRNAで共有しているtRNA断片は先に出会ったものどうしでくっついてしまうという、早い者勝ちの原理がはたらく。それぞれのtRNA断片が無事に成熟したtRNAになれるようにするには、細胞内で発現するtRNA断片の量をうまく調節する必要がある。さもないと、特定のtRNAの生産量が追いつかず、タンパク質合成が滞ってしまう場合もあるだろう。このように断片化した遺伝子をつなぎ合わせるというしくみは、非効率な面があるが、一方、断片を組み換えることによって新たな機能を生む利点もある。カルディヴィルガは古細菌の系統樹の根元に近い位置から分岐しているので、原始的な遺伝子の構造を残していてもおかしくはない。短いRNA断片を組み合わせる試行錯誤が長いtRNA遺伝子の原型となり、ゲノムに固定されたと考えることができそうに思う。
私たちは時間を戻すことはできないが、初期の生命システムの痕跡を自然界から探すことは可能である。今後は、split tRNAが本当に初期の生命系の形質を残したものであるのかを確かめるために、深海や地中深くに生息する古細菌の解析を考えている。中には1年に1度分裂する程度で、進化速度も遅いと考えられている種もある。これらは培養困難だが、今では1細胞でのゲノムDNAの解読も可能となってきたので、新たなsplit tRNAや、あるいは全く違うタイプの遺伝子が見つかるかもしれない。これらの生きものの中に、生命システムの起源や進化モデルにあてはまる痕跡が残っている可能性を考えるだけでもワクワクする。
藤島皓介(ふじしま・こうすけ)
慶應義塾大学先端生命科学研究所博士研究員。2009年に慶應大学大学院先端生命科学プログラム後期博士課程修了、博士(学術)。初期の生命が使っていたシステムに興味を持って古細菌とコンピュータに向き合う日々を送っている。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)
.jpg)
.jpg)