ライブイメージングで捉えたエンハンサーの転写制御
深谷雄志
東京大学
ゲノムには生きものを形づくる全ての情報が入っている。そこから適切なタイミングで適切な遺伝子が読み出され、必要なタンパク質が次々とつくられていく。
遺伝子がタンパク質をつくる最初の一歩は転写である。転写活性を光で見るライブイメージングの新技術を用いた研究から、ゲノムの複雑な立体構造の中で動的にはたらく転写のしくみが見えてきた。
1.遺伝子の「使い方」が大事
地球上に存在する生きものの多様性はどのように生み出されているのだろうか? 現代の生命科学では、設計図であるDNAの違いによって説明できる、という考え方が主流である。では、DNAのどのような「違い」が、生きものを形づくるのか? 最も単純な考え方は、より複雑な形の生きものほど、より多くの数の遺伝子をもち、より多くの種類のタンパク質をつくり出せるというモデルである。しかし実際には、ヒトと道端に生えているコケの遺伝子数はあまり変わらない。近年のゲノム解析から、遺伝子の「数」ではなく、遺伝子の「使い方」に大きな違いがあることが分かってきた。レゴブロックに例えるなら、同じ数のブロックを使って組み立てても、幼児と大人ではその仕上がりに大きな差が現れるように、大事なのは与えられた部品の数ではなく、それをどう使いこなすかなのだ。ゲノムでこの役割を担っているのがエンハンサーと呼ばれる調節配列である(Banerji et al., Cell 1981)。
エンハンサーが遺伝子のはじめにあるプロモーター配列に作用することで、転写酵素によって遺伝子からmRNAがつくられる(図1)。この転写の過程が、遺伝子がはたらくための最初の一歩である。そこで、転写がおきている箇所に蛍光タンパク質を集め、光の強さで転写活性を測るライブイメージングの技術を用い、ショウジョウバエの胚発生におけるエンハンサーのはたらきを調べた。
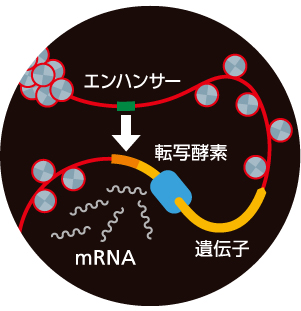
(図1)転写
2.遺伝子の発現を調節するエンハンサー
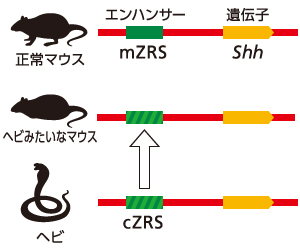
エンハンサーは遺伝子の転写をいつどこでオンにするかを制御するスイッチである。スイッチが壊れる、つまりエンハンサーのDNA配列に変異が生じると、遺伝子自体は無傷であってもその発現に大きな異常が生じる。その結果、癌などの疾患を引き起こす原因となることも報告されている。もちろんエンハンサーは疾患だけではなく、形の多様化や、生きものの進化とも密接に関連している。その例を一つ紹介しよう。ヒトやマウスの手足の形成には、初期胚肢芽でSonic hedgehog(Shh)遺伝子が適切に発現する必要がある。Shhを転写活性化するのはZRSと呼ばれるエンハンサーである。一方ヘビは、ヒトやマウスと異なり、四肢をもたない特殊な形を進化の過程で獲得してきた。ヘビにもZRSエンハンサーがあるが、そのDNA配列はヒトやマウスとは微妙に異なる。ゲノム編集技術(註)を用いてマウスのZRSエンハンサーをヘビのZRSエンハンサーと入れ替えると、驚くべきことに手足の形成が著しく退化した「ヘビみたいなマウス」が生まれくる。この結果は、遺伝子自体は全く同じでも、エンハンサーの違いによって生きものの形が大きく変わることを示している。
3.エンハンサーによる転写バーストの制御
エンハンサーの生物学的な重要性が明らかとなる一方で、そもそもエンハンサーがどのように標的とする遺伝子の転写を制御するのかという基本的なしくみは、驚くほど理解されていない。私たちはショウジョウバエ初期胚を用いて、エンハンサーが転写活性化する瞬間をリアルタイムに観察するライブイメージング技術を新たに構築し、この謎の解明に取り組んだ。その結果、エンハンサーは標的遺伝子からオンとオフを繰り返す不連続な反応であるバースト状の転写活性を誘導することを、初めて可視化により明らかにすることができた(図2)。こうした転写活性のオンとオフのゆらぎは細菌から酵母、ショウジョウバエ、哺乳類まで広く普遍的に保存され「転写バースト」と呼ばれている。
- 動画1 Lim et al., PANS 2018
- 動画2 Yokoshi et al., Mol. Cell 2020
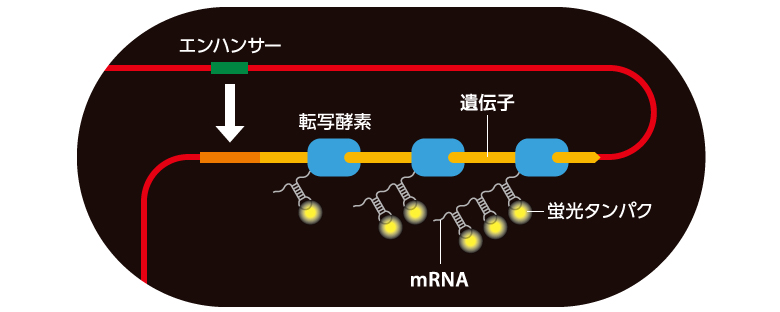
(図2)ftz遺伝子のライブイメージング
ショウジョウバエの初期胚でストライプ状に発現するftzの転写バーストを捉えた。
(動画1:赤は核を、光は転写活性を示す。動画2:グレーは核を、光は転写活性を示す。)
さらに、さまざまなエンハンサーの転写バーストを調べたところ、より強く遺伝子を発現させるエンハンサーほど、転写バーストが高頻度に起きていた。その一方で、1回あたりの転写バーストの強さに大きな差は見られなかった。これらのことから、エンハンサーは時間当たりに何回転写バーストが起こるかを制御することで、遺伝子発現を緻密にコントロールしていることがわかった(図3)。先ほどの例で考えると、ヘビのエンハンサーとマウスのエンハンサーでは転写バーストを生み出す能力が異なるため、Shhの発現パターンが変わり、その結果として表現型に違いが生まれると考えることができる。
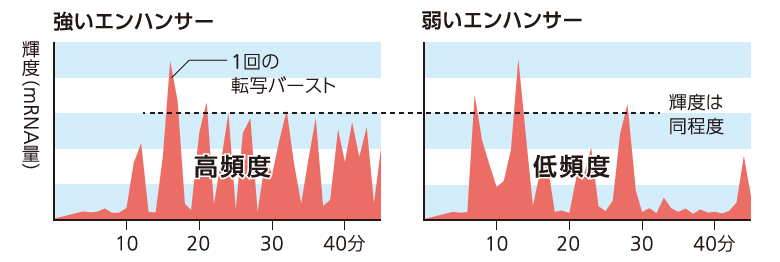
(図3)エンハンサーによる転写バーストの制御
転写バーストの頻度が遺伝子の発現量を規定することがわかった。
4.遺伝子とエンハンサーの位置関係で異なるTADの役割
細胞の中でゲノムは立体的に折り畳まれている。その折り畳まれ方は決してランダムではなく、ループ領域が数珠状に連なったTAD (Topologically Associating Domain)と呼ばれる構造をとる。TADには、ループを形成する起点となる境界エレメントと呼ばれるDNA配列が必要である。境界エレメントにはCTCFと呼ばれるタンパク質が結合している。コヒーシンと呼ばれるリング型のタンパク質複合体がDNAを手繰り寄せて行き、CTCFに出会うとそこで立ち止まる。このことにより、一対の境界エレメントを起点にしてゲノムが折り畳まれてゆきTADが形成されると考えられている(図4)。
エンハンサーはこうした複雑なゲノムの三次元構造の中で、その機能を発揮している。実際、エンハンサーと標的遺伝子は同じTAD内に位置していることが多い。そのため、TADがエンハンサーと標的遺伝子を物理的に近づけ、転写活性化を助けていると想像できるが、本当にそのようなはたらきがあるのだろうか?
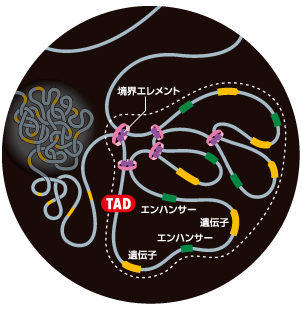
(図4)TAD
私たちはTADの機能を実験的に検証するため、ショウジョウバエの初期胚で分節化を司る遺伝子fushi tarazu(ftz)とホメオティック遺伝子(註)のSex combs reduced(Scr)に着目した。ftzはショウジョウバエの初期胚で7つのストライプ状に発現しており、ftzと同じTAD内に位置する複数のエンハンサーによって制御されることが知られている。ゲノム編集によって境界エレメントを削除しTADの形成を阻害したところ、予想に反してftzは依然としてストライプ状に発現した。この結果は、TADが形成されない場合でも、エンハンサーは標的遺伝子から転写バーストを生み出せることを示している(図5)。
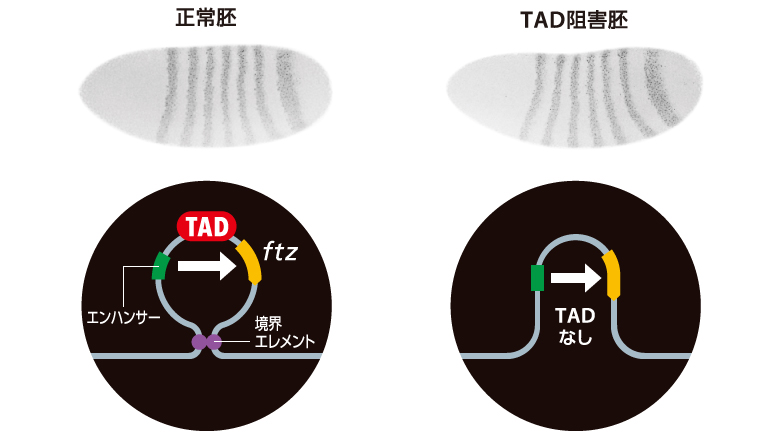
(図5)ftz遺伝子の発現はTADに依存しない
TADの形成を阻害しても、ftzは正常胚と同程度に発現した。
Scrは、ftzを含むTADに隔てられた遠くのエンハンサーによって制御されることがわかっている。TADの形成を阻害するとftzの解析結果とは異なり、Scrの発現がほぼ完全に失われた。このことは、エンハンサーが間の遺伝子を飛び越えて転写を活性化する特殊な場面において、TADの形成が必須であることを示唆している。つまり、一部のエンハンサーがもつ「遺伝子飛び越え活性」はTADによって説明できるということだ。生きものはTADを巧みに利用しながら、どのエンハンサーがどの遺伝子にはたらきかけるのかを緻密に制御していることが明らかとなった(図6)。
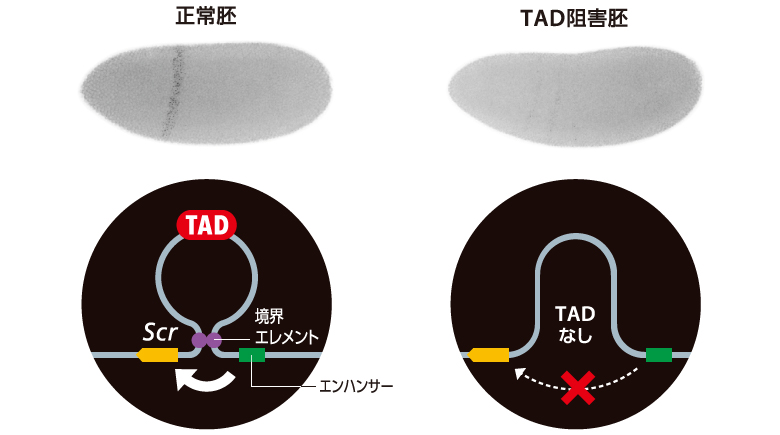
(図6)Scr遺伝子の発現にはTADが必須である
TADの形成を阻害すると、Scrの発現がほぼ完全に失われた。
5.転写を活性化するゆるやかな「場」
エンハンサーは通常、同じ染色体上にある遺伝子にはたらきかける。しかし、今から60年以上も前にエドワード・ルイス(註)は、ショウジョウバエを用いた遺伝学解析で、エンハンサーが染色体を飛び越えて相同染色体間で遺伝子を転写活性化するトランスヴェクション(Transvection)という現象を明らかにした(Lewis, Am Nat 1954)。しかし、エンハンサーがどのように相同染色体間で作用するのかは明らかでなかった。私たちの研究により、実はトランスヴェクションは前述の「遺伝子飛び越え活性」と同様のしくみによって起こる現象であることがわかった。
これまでの研究により、境界エレメントがトランスヴェクションに関与することはわかっていた。そこで私たちは、一方の相同染色体にエンハンサーを、もう一方に標的遺伝子をもつ一対の相同染色体に、さまざまな境界エレメントの配列を挿入して遺伝子の転写活性を調べた。その結果、相同染色体間で一対の境界エレメントが成立した場合に、トランスヴェクションが起こることがわかった。境界エレメントにはTADの形成とは別に、相同染色体同士を引き寄せ合うはたらきがあるのだ(図7上段)。
さらに、一方の相同染色体にエンハンサーと標的遺伝子が、もう片方に別の標的遺伝子がある場合のトランスヴェクションについてライブイメージングで調べた結果、2つの遺伝子から「同時に」転写バーストが生み出される瞬間を捉えることができた。このことから、エンハンサーは一対一のループ構造を介してではなく、転写を活性化する緩やかな「場」を形成することで標的遺伝子にはたらきかけていると考えられる(図7動画)。
また、同一の染色体上で1つのエンハンサーが2つの遺伝子を活性化する場合、これまでエンハンサーはどちらか一方の遺伝子を転写活性化した後、再びもう片方の遺伝子を転写活性化するというように、相互排他的に作用すると考えられていた。しかしライブイメージングで調べると、トランスヴェクションの結果と同様に、2つの遺伝子が「同時に」活性化していた(図7下段)。
Lim et al., Mol. Cell 2018
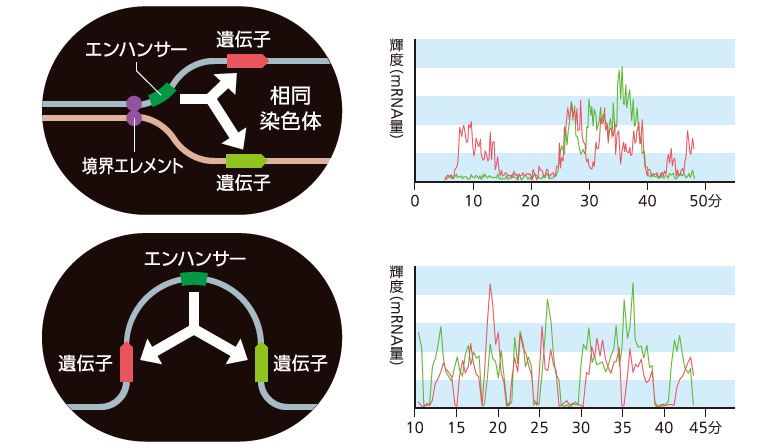
(図7)転写ハブモデル
相同染色体間(上段・動画)と、同一染色体内(下段)の両方で、1つのエンハンサーが2つの遺伝子を同時に転写活性化する様子が見られた。(動画:青は核、赤と緑は遺伝子の転写活性を示す。)
従来、エンハンサーは標的遺伝子と安定的なループ構造を形成して転写活性を制御していると信じられてきた。分子生物学の教科書にもそのような模式図が描かれている。もしこのモデルが正しければ、1つのエンハンサーは1つの遺伝子しか同時に活性化することができないだろう。しかし私たちの研究から、エンハンサーによる遺伝子の転写制御はゲノムの構造変化を伴う、これまで考えられてきたよりもはるかに動的なしくみであることがわかった。こうした新しいエンハンサーの作用機序は「転写ハブモデル」と呼ばれ、現在大きな注目を集めている。今後私たちは、転写のハブの実態を分子レベルで解明することで、新たな転写制御モデルを確立したいと考えている。

深谷雄志(ふかや・たかし)
2014年東京大学新領域創成科学研究科博士課程修了。博士(生命科学)。カリフォルニア大学バークレー校博士研究員、プリンストン大学博士研究員を経た後、2018年より東京大学定量生命科学研究所生命動態研究センター講師。2014年日本学術振興会育志賞、2019年文部科学大臣表彰若手科学者賞受賞。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)

.png)