RESEARCH
光合成蛋白質の形から知る植物の賢さ
まずはここから…リサーチのツボ
1.違いがありながら似ている光合成と酸素呼吸
光合成では光エネルギーを利用して、二酸化炭素から生物のエネルギー源となるブドウ糖を作り出す([生命誌33号Research] 細胞が行なうリサイクルとその進化)。そのしくみは大きく二つにわけられ、一つは、光エネルギーを化学エネルギーに変える明反応であり、3種の膜蛋白質複合体とキノン類(膜中の補因子)、可溶性の電子伝達蛋白質(プラストシアニン、フェレドキシン等)で成り立っている。二つめが、そこで得られた化学エネルギーで二酸化炭素からブドウ糖を作る暗反応である。明反応のなかで、光と反応する2つの膜蛋白質複合体をつなぐ大切な役割をするのがシトクロムb6f 複合体なのだが、実は光合成とは反対の反応をする酸素呼吸(糖からエネルギーを取り出す)の電子伝達系で活躍するミトコンドリア呼吸鎖のシトクロムbc1複合体ととてもよく似ているのである。そこで、光合成と酸素呼吸との共通点と相違点に着目しながら、シトクロムb6f 複合体の構造を調べ、機能を見ていった。
シトクロムb6f 複合体は光合成をする葉緑体の内膜にある。分子量22万ととても大きな超分子複合体である。光化学系IIとIという蛋白質の間で電子の受け渡しをし、チラコイド膜のストローマ側からルーメン側へと水素イオンをくみ上げる(図1)。b型とc型の二種類のシトクロム(註1)が含まれるので、酸素呼吸の電子伝達系ではたらくシトクロムbc1複合体と共に、シトクロムbc複合体と総称される。シトクロムb6f とbc1複合体は膜貫通領域のアミノ酸配列が似ている上に、電子をやりとりする相手が、膜の中で電子を運ぶキノン類(プラストキノン:シトクロムb6f 複合体、ユビキノン:シトクロムbc1複合体)と細胞質中で電子を運ぶ蛋白質(プラストシアニン:シトクロムb6f 複合体、シトクロムc:シトクロムbc1複合体)であるという共通点もある。
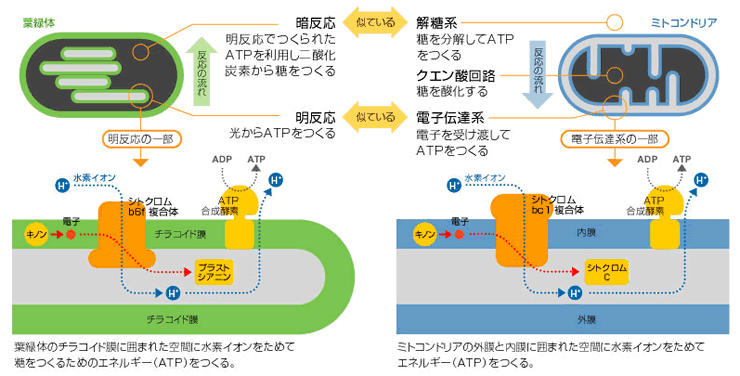
(図1)光合成と酸素呼吸
一方、b6f 複合体では膜中の大きなサブユニットが2本のアミノ酸の鎖シトクロムb6とサブユニットIVとに分かれているのに対し、bc1複合体は一体化しているという違いもある。この違いは、bc複合体のサブユニット組成が分子としてどのような進化をしてきたのかという観点からも大変興味深い。例えば、納豆をつくる細菌の仲間のグラム陽性細菌Bacillus属のbc複合体が光合成と同じb6f 型であり、光合成細菌R. capslatus由来のbc複合体は酸素呼吸と同じbc1型である。無関係に見えるグラム陽性細菌と高等植物が共通のb6f 型祖先をもち、光合成細菌とミトコンドリアとが共通のbc1型祖先を持っているという関係からも、光合成と酸素呼吸が相互に関連し合って来たことが推測できる。生物は、太古の昔から膜エネルギー装置を幾重にも進化させることにより、今のようなエネルギー獲得の多様性と効率化を生み出してきたのだろう。
(註1) シトクロム
生体内の条件の変化によって酸化還元のはたらきをもつヘム蛋白質の一種。
2.分子を見て初めて分かったこと
シトクロムbc複合体の中で初めて立体構造が明らかになったのが酸素呼吸に使われるシトクロムbc1複合体であり、牛の心筋から単離され、1997年に報告が出された。私たちはラン藻から単離した光合成に関わるシトクロムb6f 複合体の立体構造を2003年に明らかにした。一般的に、膜蛋白質は精製するのに手間がかかり、X線結晶構造解析に適した結晶をつくるのが難しい。私たちもかなり苦労したが、3.0Åの分解能で構造を明らかにすることに成功した。光合成の電子伝達系で最後まで立体構造のわからなかったシトクロムb6f 複合体分子の立体構造を手に入れた今、光合成電子伝達反応のすべての反応が立体構造に基づいて議論できることになった。ここでシトクロムb6f 複合体の立体構造を詳細に見ていこう(図2)。さまざまな分子が関わり合い複雑だが、図を見比べながら考えて欲しい。
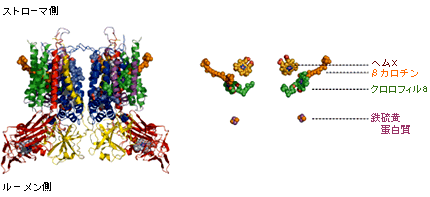
(図2)シトクロムb6f 複合体の立体構造
X線結晶構造解析によってシトクロムb6f 複合体の全体像が明らかになった。右図は特徴的な補欠分子属を抜き出したもの。
蛋白質分子の大きさは、膜のルーメン側で約120 x 75Å、膜貫通部分で約90 x 55 Åである。膜のルーメン側にあるのは、c型ヘムをもつシトクロムfと [2Fe-2S]クラスターを持つ鉄硫黄蛋白質の可溶性部分である。この二つは共に電子を受け渡すための酸化還元中心なのだが、その距離が29Åもあり、そのまま電子を受け渡すには遠すぎる。ウシやニワトリのシトクロムbc1複合体の場合、鉄硫黄蛋白質の可溶性部分とシトクロムc1は35Åも離れてはいるが、鉄硫黄蛋白質の可溶性部分が形をダイナミックに変化させて(シャトル運動)電子を受け渡しているといわれている。シトクロムb6f 複合体も同じように鉄硫黄蛋白質のシャトル運動で2つの酸化還元中心が近づき、電子が受け渡されるのだろう。
シトクロムb6f 複合体の膜貫通領域から特徴のある3種の補欠分子族(註2)が見つかった(図2)。一つめは複合体の奥まったところにしっかりと挟み込まれたクロロフィルa分子。二つめがb6f 分子の外側に突き出るβカロチン。三つ目は、3種のヘム分子。この3種類目がくせものだ。分光学的研究から予測された2つのb型ヘム以外にもう一つ余計なヘムがあったのである。このヘムは今までに知られているヘムa、b、cとは異なり既存のカテゴリーに分類できないので”ヘム x”と名づけた。これまでヘムxを確認できなかった理由は二つ考えられる。「シトクロムb6f 複合体がシトクロムbc1複合体と同じである」という強い固定概念と、シトクロムb6f 複合体の精製の難しさである。可溶化しづらい膜に埋まった状態の蛋白質を活性を保ったまま精製するには大変な手間がかかる。ヘム xを発見した後に、シトクロムb6f 複合体に関する分光学の論文を確認したところ、ヘムxと思われるシグナルが存在するという記述があった。しかし、シトクロムb6f 複合体の精製が難しいために、そのシグナルは不純物由来もしくはもともと含まれるb型ヘムが部分的に分解したものであるとされていたのでる。蛋白質を網羅的に調べるプロテオミクス研究でも同様に扱われている。実際に質量分析計で測ってみると、予想される分子量よりもヘム1つ分だけ多い。シトクロムb6f 複合体に含まれる蛋白質を電気泳動ゲルで分離し、ヘムで染色するとシトクロムb6に対応する部分が染色される。つまり、どのデータもシトクロムb6に3種類目のヘムが存在することを示しているのだ。そこからヘムxの存在が伺い知れるのに、シトクロムb6f 複合体の精製が不十分だったとして十分な考察がなされていなかったのである。
それでは、b6f 複合体に特徴的な補欠分子族クロロフィルa、βカロチン、ヘムxの結合は、光合成のはたらきにどう関係しているのだろう?最近、その立体構造が明らかになった光合成細菌R. capslatusのシトクロムbc1複合体と比較してみた(図3)。
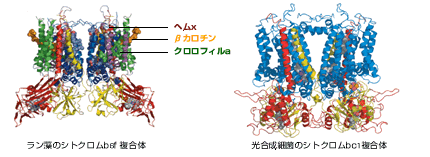
(図3) シトクロムbc1複合体とシトクロムb6f のわずかな違い
ラン藻のシトクロムb6f 複合体と光合成細菌のシトクロムbc1複合体はよく似た形をしているが、光合成細菌のシトクロムbc1複合体にはヘムx、βカロチン、クロロフィルaがない。
クロロフィルaが結合している部分は、光合成細菌ではシトクロムbの一部分でうまっており、b6f 複合体がβカロチンを挟み込んでいる部分は、光合成細菌には元々存在していない。その上、ヘムxに対応する場所はキノンが結合する所として空いている。一方、光合成とは全く関係のない好熱性Bacillus属のシトクロムb6f 複合体に注目すると、そこでは、シトクロムb6サブユニットにヘムが共有結合していることが報告されている。Bacillus属は光合成とは全く無関係で、クロロフィルaやβカロチンを含まない。現在、このシトクロムb6に結合しているヘムが”ヘム x”かどうか検証実験を行っているところである。光合成細菌のシトクロムよりは、光合成をしていない細菌のシトクロムの方がラン藻や植物に似ているという結果をどう考えたらよいのだろう。
(註2) 補欠分子族
蛋白質が正しい立体構造をとり、はたらくために必要な金属や有機化合物など。
3.植物ならではのやりくり
ラン藻の(おそらく高等植物も)シトクロムb6f 複合体にはなぜクロロフィルa、βカロチン、ヘムxが結合しているのだろう。一般にクロロフィルは光エネルギーを吸収するアンテナの役割をもつが、シトクロムb6f 複合体の反応は光エネルギーとは無縁である。クロロフィルは、生体にとって危険な活性酸素を発生し“劇物”になる可能性がある。シトクロムb6f 複合体ではこの発生を抑える能力のあるβカロチンが、クロロフィルからかなり離れた位置にあり、現在のところ両者の役割は不明である。
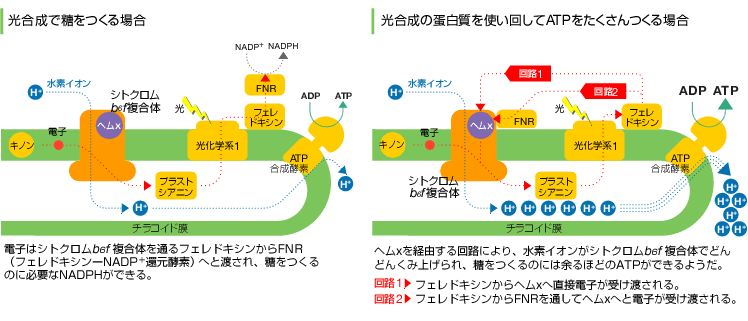
(図4) ヘムxで優先的にATPをつくる?
ただ、ヘムxの立体構造から興味深い仮説が考えられる。植物やラン藻は周囲の塩濃度が高くなるなど生育環境が悪くなると、エネルギーの素、ATPが必要となり、葉緑体のチラコイド膜上にはそのためのしくみがあることが知られている(図4)。通常の光合成では、フェレドキシンからFNRに電子を受け渡すところを、プラストキノンへと渡すことで、電子を循環させH+をどんどん運び、その濃度勾配を利用してATPをつくるのである。ところが、この反応の要となる酵素(フェレドキシン-プラストキノン還元酵素)はまだ発見されていないのである。そんな中、ヘムxは膜貫通領域の中でもストローマ側の端に位置しているので、フェレドキシンを介して循環する経路に関与している可能性が高いと考えられる。特にシトクロムb6f 複合体のストローマ側の分子表面はリジンやアルギニンなどの塩基性のアミノ酸が多く塩基性なので、アスパラギン酸やグルタミン酸の多い酸性蛋白質のフェレドキシンと、直接相互作用する可能性も考えられる(図5)。もちろん、他の蛋白質を介する可能性も否定できない。高等植物では、フェレドキシン-NADP+還元酵素(FNR)が、b6f 複合体と接しているという報告がある。動物と違い、環境が悪化しても逃げることができない植物が、ヘムxを使って優先的にATPをつくるという仮説は、大変興味深い。
X線による詳細な構造解析で、構造-機能相関は全て解明されると思われがちであるが、構造研究の現場にいると、今回のように新しい問題点が浮びあがってくることもしばしばである。今後、様々な生物種由来のシトクロムb6f 複合体の結晶構造が明らかになり、分子進化の観点からも新しい知見が得られるであろう。
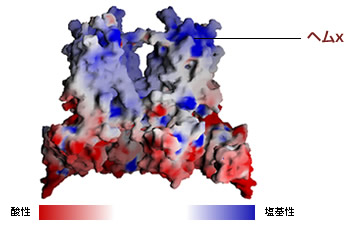
(図5) シトクロムb6f複合体の表面の様子
赤い方が酸性で青い方が塩基性で、ヘムxの辺りは塩基性が強いことが分かる。
栗栖源嗣(くりす・げんじ)
1997年大阪大学大学院工学研究科博士課程修了、工学博士。日本学術振興会特別研究員DC1、大阪大学蛋白質研究所助手を経て、2004年より東京大学大学院総合文化研究科助教授。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)
.jpg)
.jpg)