RESEARCH
ゲノムインプリンティングとホ乳類の進化
生物がこれだけ多様であるのに、全ての生きものがもつ遺伝情報システムが共通していることは、進化が実際に起きたことを示す最大の証拠だろう。しかし、“どのように進化が起きたか”、すなわち進化の機構を科学で証明するのは難しい。歴史性のある一回性の現象(宇宙の起源等も同じ)を扱うには、従来の科学がもつ“実験による再現性を基にした枠組み”とは別の思考の枠組みが必要とされるのである。ここで、“生物のもつゲノムのはたらき、つまり機能がその生物を特徴づけている”という考え方をするなら、“進化は新しいゲノム機能の獲得によって起きる”という進化に対する新しいアプローチが見えてくる。すなわち、ある一群の生物に特徴的に見られるゲノム機能がどのように獲得されたかを知ることが、進化機構を知る上での鍵にちがいない。幸いその証拠がゲノムに残されている場合には、“ゲノムに残された新しい構造と機能の関係”の解析により、進化という歴史性のある課題も科学的検証が可能になるはずだ。 ホ乳類に特有なゲノム機能である「ゲノムインプリンティング」は、ヒトを含むホ乳類の個体発生に必須である。本稿では、はじめにこの現象の生物学的意義を考察し、それに基づいた進化機構研究へのアプローチを紹介する。ヘッケルの有名な命題“個体発生は系統発生を繰り返す”は今では間違っていることが判っているが、“ゲノム構造の変化とゲノム機能の獲得”を調べることで、個体発生と系統発生を結ぶ新たな関係が見えてくるだろう。
1.不利に見えるゲノムインプリンティングがなぜ存在するのか?
ホ乳類の細胞は父親と母親由来の染色体を持つ2倍体であり、多くの遺伝子はどちらの染色体でも同等に発現する。そのため、劣性遺伝病の原因遺伝子を片親から受け継いでも、もう一方が正常に機能していれば、その遺伝病は発症しない。このように、2倍体の細胞をもつことは生物にとって大きなメリットとなっている。ところが、前回紹介したゲノムインプリンティングは、ある一群の遺伝子が父親または母親に由来した時にしか発現しないという機構である。このような遺伝子(刷り込み遺伝子と呼ぶ)はせっかく2倍体の構造を持ちながら、その機能が1倍体と同じ状態になっている。そのため、ホ乳類は精子と卵子の受精によって両者のゲノムが揃わなければ正常に発生できないことになる。
なぜこのように2倍体の利点を捨てた遺伝子発現制御機構がホ乳類には存在しているのであろうか。この機構が現在までホ乳類に保存されてきたからには劣性遺伝病の発症による犠牲を上回るメリットがあるはずだ。
1984年にゲノムインプリンティングによる父親・母親由来の染色体の機能的な差が発見されてから、この現象のもつ生物学的意義について、さまざまな仮説が発表されたが未だ結論はでていない。ここでこれまでに出された代表的な仮説を挙げておこう。
-
単為発生防止説
ゲノムインプリンティングの発見のきっかけになったのは、受精卵を前核移植操作して作成した父親または母親由来のゲノムのみを持つ胚が、初期胚期に必ず死ぬという実験結果であった。このため、単為発生を防止するためにこの機構が生じたという考えが早くに示された。確かに、子供を母親の体内で養育するホ乳類にとっては、雌性単為発生を防ぐことは重要だ。
-
悪性卵巣性腫瘍防止説
母親のゲノムのみをもつ雌性単為発生胚では胎盤の形成が起こらない。そのため、卵巣性腫瘍が悪性化するのを防止するという仮説が提唱された。
-
コンフリクト仮説
胎生という生殖様式を示す動物では、雄は自分の子供を大きくするように、一方、雌は1回の出産の負担を減らし機会を増やすために子供を小さくするように進化上の圧力がかかる。つまり、父親性発現遺伝子は胎児の成長促進を、母親性発現遺伝子は、成長抑制に働くという仮説である。
-
外来のウィルス遺伝子等からのゲノム防御説
外来のウィルス遺伝子等がゲノムに挿入された場合に、それの発現を抑制するためのDNAメチル化機構が働いた結果の副産物として生じたという仮説。これはゲノムインプリンティング自体には生物学的意義はないという立場である。
-
胎盤仮説
ゲノムインプリンティングは胎盤を持つホ乳類に特有の機構のため、胎盤と言う新しい臓器を生みだすため“何らかの役割”を果たしたのではないかという仮説。
これらの仮説に対し、私たちは最新の実験的データに基づき、ゲノムインプリンティングの成立がホ乳類の進化の過程で重要な意味を持つことを示す2つの仮説をたてた。
2.ゲノムインプリンティングの制御体系
まず、我々はゲノムの機能に着目し実験を進めてきた。特定の刷りこみ遺伝子(インプリンティング遺伝子)を変異させたノックアウトマウスを作り、生物の生理・生態にどのような影響があるかを調べ、その遺伝子のはたらき(機能)を推定しようと考えたのである。数多くのインプリンティング遺伝子を体系的に同定して、機能的な共通性を見出し、そこから生物学的な意味を知ろうというわけだ。ところが、インプリンティング遺伝子の種類が増えれば増える程、成長に影響を持つもの、発生の様々な時期の致死性に関係するもの、母性保育行動に影響するもの、生理・生態に影響の無いもの(表現型が顕著でない)等さまざまで、機能の共通性を認めるのは難しくなってきた。一方で、多数の遺伝子が同定されて明らかになった重要な事実は、インプリンティング遺伝子は複数で群(クラスター)を成して存在するという、構造上の共通性だった。ただし、ホ乳類の場合は遺伝子がクラスターを形成したとしても、それが機能として関わり合うというわけではない。
そこで私は、インプリンティング遺伝子そのもののはたらきでなく、それをはたらかせるしくみ、つまりゲノム構造に依存した発現制御体系の持つ意味を考えるべきだろうと考え、研究の方向を転換した。その例が、始原生殖細胞(精子/卵子の基となる細胞)から作ったクローンマウスの解析(生命誌ジャーナル2003年秋号:ゲノムインプリンティング-世代に刻みこまれる時)である。前回はインプリンティング遺伝子には、父親由来ではたらくPeg(Paternally expressed genes: 父親性発現遺伝子)と母親由来ではたらくMeg(Maternally expressed genes: 母親性発現遺伝子)の2種類があり、10.5-11.5日胎児期の生殖細胞で、両者の刷りこみが急速に消去されていく過程を説明した。これまでゲノムインプリンティングの話を聞いていた人の中には「刷り込みの完全な消去」は「父母由来に関わらず全てのPegとMegがはたらける状態」になることと思われていた方が多いのではないかと思う。だが前回の図(生命誌ジャーナル2003年秋号:ゲノムインプリンティング-世代に刻みこまれる時)を見て、実は、この考えは正しくなく、この実験がもう一つの重要な結果を導いていたことに気がつかれた方もおられるかも知れない。前回は混乱を避けるため敢えて隠しておいたが、ゲノムの構造を視野に入れた新しい図で見ていこう(図1)。複雑なので文と図を見比べながら考えていただきたい。
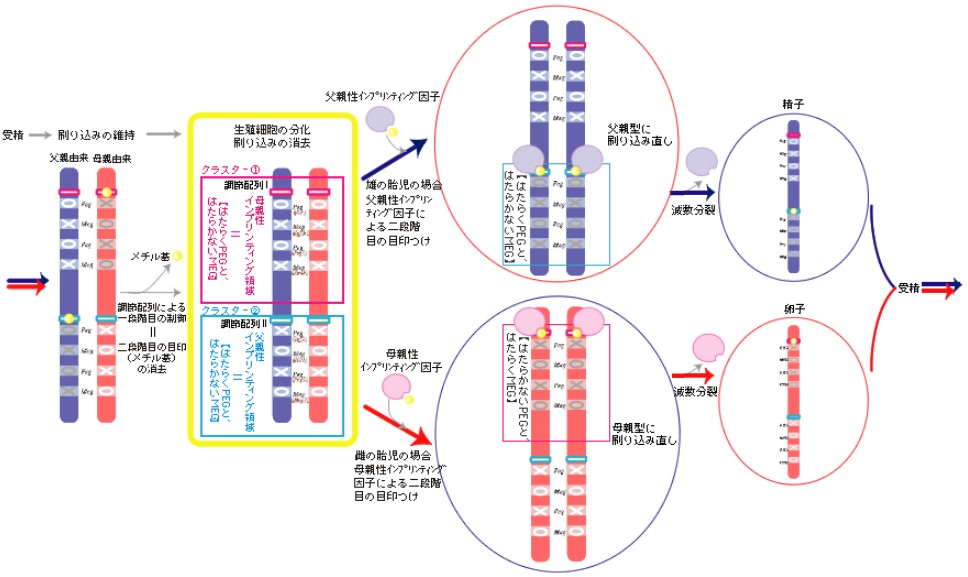
(図1) 胎児期の始原生殖細胞でおこるゲノムインプリンティングの刷りこみなおし
インプリンティング遺伝子は父親性あるいは母親性インプリンティング領域のいずれかに属し、領域内の特定のDNA調節配列による一段階目の制御をうける。これが生殖細胞の刷りこみが消去された状態で、インプリンティング遺伝子は父母性インプリンティング領域ごとに【Peg(Meg)がはたらく/Meg(Peg)がはたらかない】パターンを示す。次に刷りこみなおしが始まると、それぞれの領域で一段階目の制御が逆転される(雄なら父親性インプリンティング領域に父親性インプリンティング因子による調節領域のメチル化、雌なら母親性インプリンティング領域に母親性インプリンティング因子による調節領域のメチル化)。こうして、調節領域のメチル化による二段階の制御を受けた精子と卵子が完成する。受精によって生まれた次世代の個体はその記憶を持ち続け、父母由来の対立遺伝子で異なるはたらきをするのである。
刷りこみ消去の状態では、刷りこみ遺伝子のはたらきに父母由来の差異がなくなるのは前回述べた通りだ。しかし、このとき全てがはたらくのではなく、父母由来の対立遺伝子がともにはたらく場合と、共にはたらかないものとに別れたのだ。どちらの場合も父母由来の差がなくなったということが重要なのである。はたらくか、はたらかないかのパターンを体系的に調べると、PegとMegはクラスター中に混在し、さらに、【はたらくPegとはたらかないMeg】と【はたらかないPegとはたらくMeg】というセットが、独立のクラスターを成していることが分かってきた(言い換えれば、【はたらくPegとはたらくMeg】と【はたらかないPegとはたらかないMeg】は同じクラスターに存在し得ないということである。ただし、PegとMegのどちらかしか見つかっていないクラスターもある)。一見不可解なこの規則性は、何を意味するのだろうか。ここでPegがはたらく方をクラスター(1)、Megがはたらく方をクラスター(2)とする。刷りこみ消去の状態では、クラスター(1)に属する遺伝子は父母由来に関わらずPegがはたらきMegがはたらかない。実はこれは、精子のインプリンティング遺伝子と同じパターンである。逆に、クラスター(2)に属する遺伝子はMegがはたらきPegがはたらかないという、卵子と同じパターンなのだ。つまり、クラスター(1)を刷りこみなおすには、雄の場合はそのまま、雌でははたらきを逆転する必要がある。また、クラスター(2)を刷りこみなおすには、雌はそのまま、雄ははたらきを逆転する必要がある。そこで、雌で逆転が起こるクラスター(1)を母親性インプリンティング領域と呼び、ここに母親性インプリンティング因子(Pegの発現抑制とMegの発現誘導とを同時におこなう)を想定した。雄で逆転が起こるクラスター(2)は父親性インプリンティング領域であり、父親性インプリンティング因子(Pegの発現誘導とMegの発現抑制を同時におこなう)があると考えた。こうして整理していくと、体細胞でのはたらきを基にしたPegとMegという分類に、生殖細胞での刷り込み機構の観点を加えた新しい分類ができる(表1)。さらに最近の研究により、刷りこみ消去の状態でPegとMegのはたらきを決めている目印は、個々の遺伝子に作用する何らかの因子ではなく、インプリンティング領域内に存在する特定のDNA調節配列であると推測できた(※これは、ホ乳類のゲノムには特殊な遺伝子発現調節がなければ、はたらかないでいるとしか言えない状態の遺伝子が存在するという新しい概念であり、たとえばインスレータと言う機能をもったゲノム配列が遺伝子間に挿入された場合に実験的にも作ることができる(*註1)。また、雌雄の生殖細胞中に存在すると考えられる父母性のインプリンティング因子の働きによりDNA調節配列がメチル化されることで、その効果が逆転することも分かっている。

(表1)インプリンティング遺伝子の分類
とても複雑なので、制御体系について始めからおさらいしよう。インプリンティング遺伝子はまず、父親性あるいは母親性インプリンティング領域のいずれかに属することで、領域内の特定のDNA調節配列による一段階目の制御をうける。これが生殖細胞の刷りこみが消去された状態で、インプリンティング遺伝子は父母性インプリンティング領域ごとに【Peg(Meg)がはたらく/Meg(Peg)がはたらかない】パターンを示す。引き続いて刷りこみなおしが始まると、それぞれの領域で一段階目の制御が逆転される(雄なら父親性インプリンティング領域に父親性インプリンティング因子による調節領域のメチル化、雌なら母親性インプリンティング領域に母親性インプリンティング因子による調節領域のメチル化)。こうして、調節領域の完全な脱メチル化と性別に応じたメチル化による二段階の制御を受けた精子と卵子が完成する。受精によって生まれた次世代の個体はその記憶を持ち続け、父母由来の対立遺伝子で異なるはたらきをするのである。
(註1)
体細胞におけるインプリンティング領域におけるPegとMegの相互に影響しあう発現制御方式の代表的なものには、1gf2(Peg)とH19 (Meg)のインスレーターモデル、Igf2r (Meg)がAir (Peg)というantisense RNAで発現制御されるアンチセンスモデル等がある。このようにインプリンティングが相互に影響しあう発現制御は、個々の領域の解析から知られていた事実であるが、実はゲノム全体に存在するインプリンティング領域の共通した性質であることを、PGCクローンの解析は明らかにした。
3.ゲノムインプリンティングの生物学的意義に関する2つの仮説
これまで見てきたことから、ゲノム刷り込みは、特定の領域における遺伝子の発現抑制と発現誘導を同時に行う“遺伝子発現切り換えメカニズム”であり、もしもゲノムインプリンティング機構が無くなった場合、約半数のPegとMegが発現しないことになってしまうことが判る(図2)。
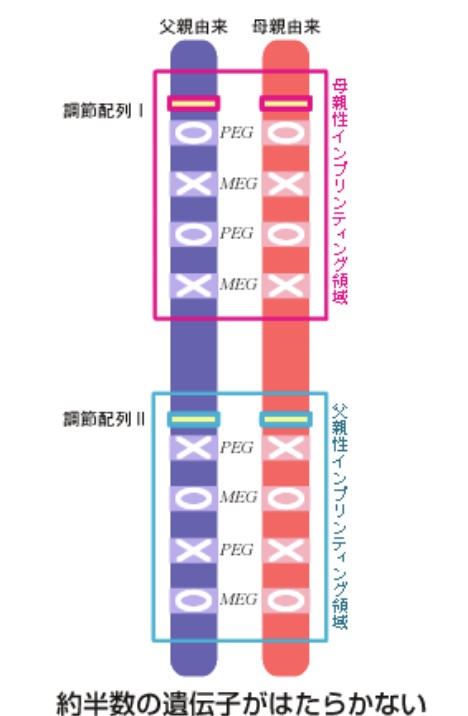
(図2) ゲノムインプリンティング機構がなくなった場合
すなわち、これらの遺伝子は、刷り込みを受けなければ、一生の間、どの組織でも発現しない“死んだ遺伝子”になってしまうわけである。一方、もし同じ領域の刷り込み、つまりメチル化が、精子形成と卵子成熟の両方で起きた場合には、これらの遺伝子は両親のどちらから来た場合でも発現をする代わりに、これまでそのような発現をしていた残りの半分の遺伝子が発現しなくなってしまう(図3)。
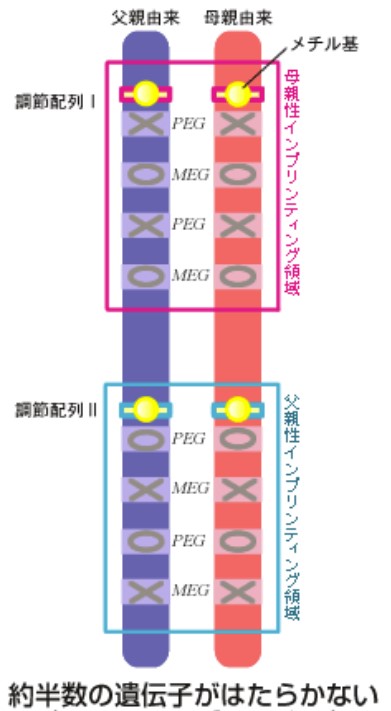
(図3) ひとつのインプリンティング領域に対して両親ともに刷り込みが起きた場合
つまり、刷り込みがなくても、両親で起きても、死んだ遺伝子が生じる。そこで、刷り込みは父親か母親のどちらか一方でだけ起こる必要があるのだ(図4)。
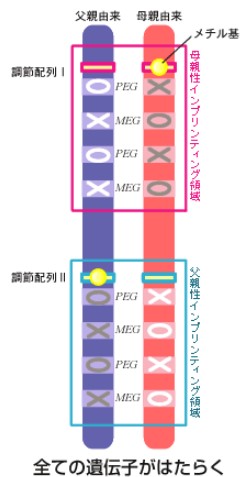
(図4)ひとつのインプリンティング領域に対して片親のみに刷り込みが起きた場合
すなわち、総てのPegとMegの発現を可能にするには片親性発現しかない。また、PegとMegの中には個体発生に必須の遺伝子が含まれるので、ゲノムインプリンティングはホ乳類の個体発生に必須の機構となるわけである。いったんゲノムインプリンティング機構が生じれば、二度とそれが無かった状態に戻ることは出来ないことは明らかで、この機構がホ乳類に保存されている理由も説明できる。このような考察に基づいて、私たちはゲノムインプリンティングが「全ての遺伝子を発現させるための機構」というコンプリメンテーション仮説(完全化仮説)を提唱した。これはゲノムインプリンティングの片親性発現の必然性を説明した初めての仮説である。
もうひとつ、ゲノムインプリンティグは胎盤形成に関係する大きな役割を持っていることも考えてみよう。PegとMegの発現パターンを体系的に調べていくと、神経に特異的なものもインプリンティング遺伝子ならば胎盤組織で必ず発現していることに気が付いた(図5)。そこで、私たちはゲノムインプリンティグが「一群の遺伝子を胎盤で発現させるための遺伝子制御機構」ではないかという新胎盤仮説を数年来提唱している。ゲノムインプリンンティングと胎盤形成の関係は以前から指摘されていたが、これは、遺伝子発現機構という観点からその内容をより明らかにした仮説である。ホ乳類が胎盤という新しい組織を獲得する時に起きた遺伝子発現調節系の変化がゲノムインプリンティングの成立と関連していたことを意味している。
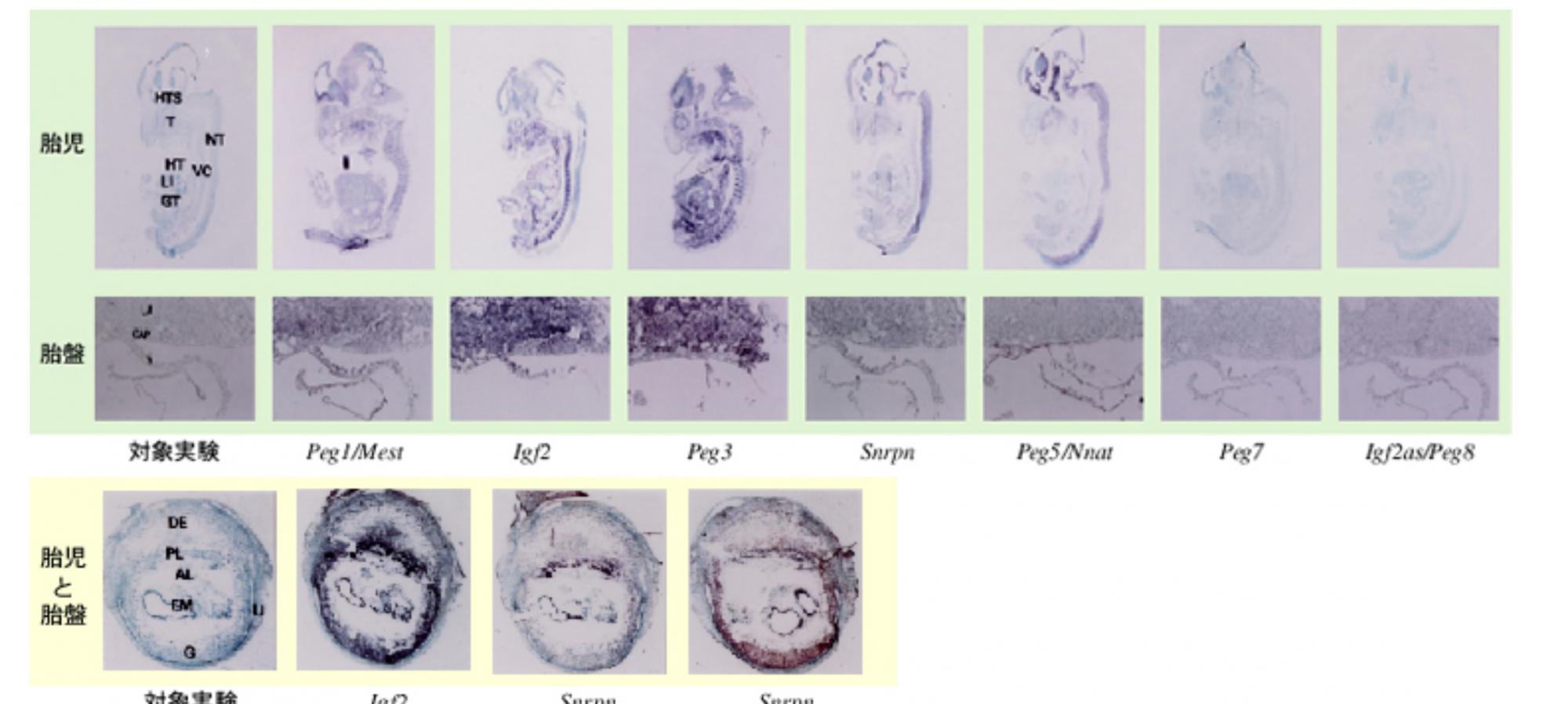
(図5) インプリンティング遺伝子の発現する位置
緑色で囲われているのが12.5日後の胎児と胎盤の様子で、黄色で囲われているのが9.5日後の胎児と胎盤の様子。染色されている部分が、インプリンティング遺伝子の発現しているところ。
胎児では、発現する位置がまちまちなインプリンティング遺伝子も胎盤では全て発現している。
HTSは視床下部、Tは舌、NTは神経管、HTは心臓、VCは脊柱、LIは肝臓、GTは腸、LAは迷路、CAPは絨毛尿膜、Yは卵黄嚢、DEは脱落膜、PLは胎盤、ALは尿膜、EMは胎児を示している。
4.ゲノムインプリンティングの成立-ゲノム構造の変化とゲノム機能の獲得から-
ゲノムインプリンティングの意義に関する2つの仮説-コンプリメンテーション仮説と新胎盤仮説-は、どちらもホ乳類の進化と関連して両立する性質のものである。ホ乳類の祖先動物を仮想してみよう。
まず前者の仮説では、ホ乳類以前には総ての対立遺伝子が通常の発現をしていたゲノムに何らかの大きな変化が起き、一群の遺伝子が発現できなくなった危機的な状態があったのではないかと考えている。このような場合、幾つかの必須な遺伝子群の発現を回復させる数少ない方法の一つが、ゲノムインプリンティングである。逆に言えば、ゲノムインプリンティングを獲得したものがホ乳類になれたということである。こんな場合は想定しなくても、対立遺伝子が普通に発現する状態から一気にゲノムインプリンティングが生じたことも考えられるし、祖先動物はすでにこの機構を獲得していたため、このような状況を生き延びることができたと考えても良いだろう。後者の仮説ではホ乳類が胎盤という新しい組織(機能)を獲得するときに起きた遺伝子発現調節系(構造)の変化が、ゲノムインプリンティングの成立と関連したと考えている。両者の仮説をつなげるには、生殖細胞で刷りこみに関わる因子やDNA配列が、胎盤組織では遺伝子発現を誘導する役割を果たしているということを実験的に証明すればよい訳だ。このストーリーを検証するべく、現在も分子機構の詳細な研究を進めている。
5.ゲノムインプリンティングとホ乳類の進化
さて、これまでゲノムインプリンティングはホ乳類に特有として説明してきた。実際にホ乳類を除いた高等脊椎動物(鳥類、爬虫類等)では、ホ乳類の刷りこみ遺伝子と相同な遺伝子は、父母由来の対立遺伝子で同等に発現し、ゲノムインプリンティングは見られない。しかし正確にはホ乳類全てにゲノムインプリンティングがある訳ではない。有袋類(カンガルー等)と真獣類(ヒトやマウスを含む有胎盤類)に特有と言わなければならない。(註:有袋類には胎盤が無く、そのため真獣類では未熟児に相当する段階で出産してしまうと思われているが、実際には卵黄嚢から変化した胎盤を持つ生物である。真獣類の絨毛性の胎盤と比べて機能的に不完全な胎盤を持っていると言うべきであろう。) ホ乳類の中で最も原始的なグループである単孔類(カモノハシやハリモグラの2属のみからなる)は卵生であり、これまでゲノムインプリンティングは知られていない。どうやらゲノムインプリンティングの成立と胎盤の獲得には関係があるようだ。ゲノムインプリンティングの進化は、実は単孔類と有袋類の間に起きたことであり、私たちが仮想状態としている変化はこの段階に起きたはずである。また、有袋類から真獣類へのより完全な機能を持つ胎盤への進化にも、制御機構(構造)の違いが反映されているのではないかと考えられる。インプリンティング領域のゲノム構造に残された変化を現存生物のゲノム機能に結びつけ、この問題を進化の実証として報告できる日も遠くないと思っている。
石野史敏(いしの・ふみとし)
1983年東京大学大学院理学系研究科生物化学専攻博士課程修了。東京大学応用微生物研究所(現分子細胞生物研究所)助手、東京工業大学遺伝子実験施設助教授を経て、現在、東京医科歯科大学難治疾患研究所教授。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)

.jpg)
.jpg)