RESEARCH
ウイルス感染細胞がたどる
生死の分かれ道
私たち脊椎動物の細胞はウイルスに感染した時、岐路に立つ。生きてウイルスと戦うか、死んで感染拡大を食い止めるか。細胞がどちらの道を選ぶのか決めるしくみを調べた。
1.ウイルスに対抗する免疫系
私たちの体を構成する細胞は、常にウイルス感染を含む様々なストレスにさらされている。細胞はストレスを感知すると、自身の置かれた状況や状態に合わせて、増殖、生存、分化、移動、細胞死などの応答を誘導し、ストレスに対抗するのである。このような細胞による適切な応答が、個体のストレス応答につながると考えられている。
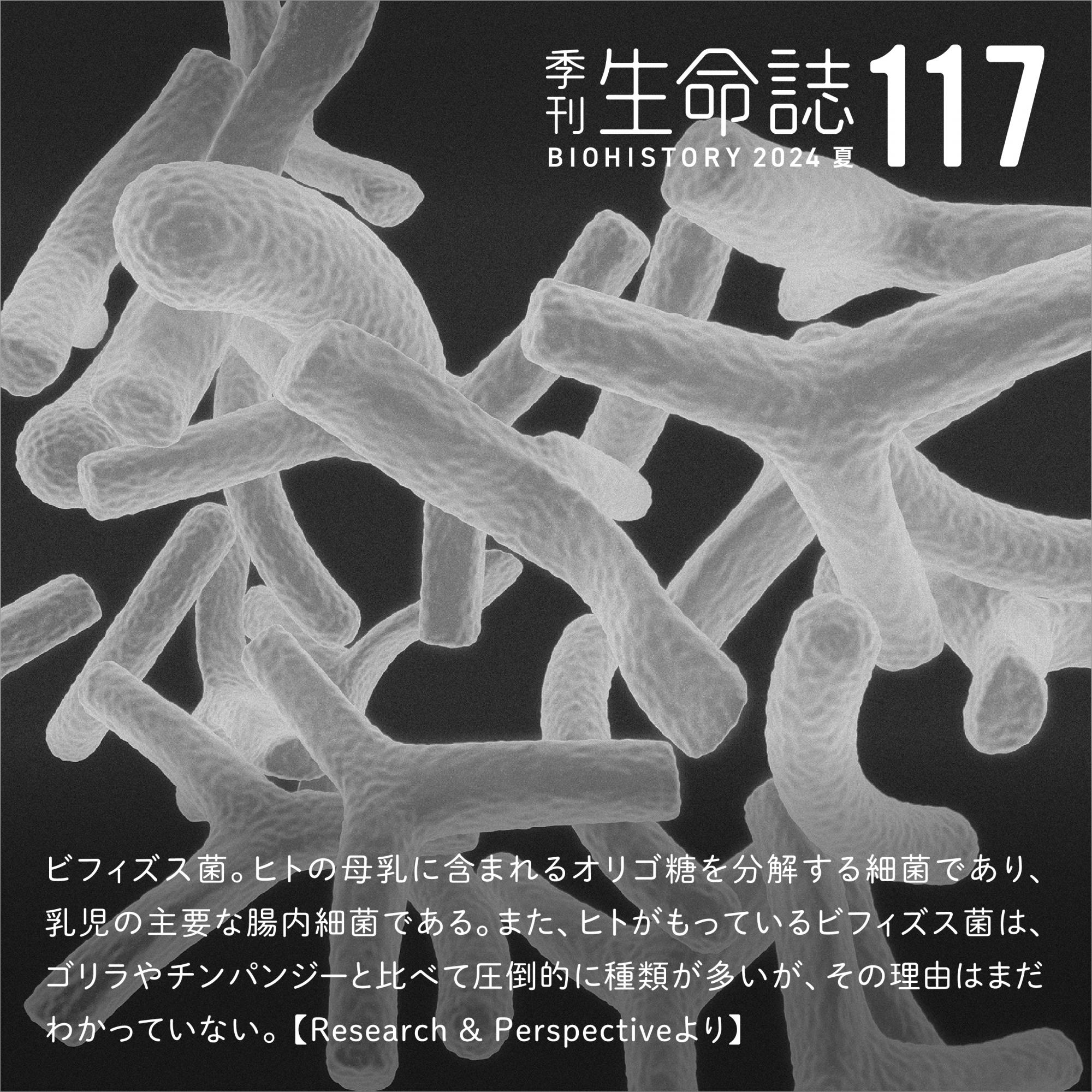
ウイルスを非自己として認識し排除する免疫機構は全ての生物に備わっているが、その中でも私たち脊椎動物は、自然免疫系と獲得免疫系の二本柱を有している。自然免疫系では細胞に局在する受容体がウイルス特有の成分を感知し、その情報を多数のタンパク質がリレーすることで様々な抗ウイルス応答を誘導する(図1)。一方獲得免疫系では、自然免疫系の応答を受けて活性化した細胞が、ウイルスを抗原として認識、記憶することで抗原の再進入を防ぐと同時に、抗体を産生するなどして抗原を排除する。
(図1) ウイルスに対抗する細胞内の情報伝達(例:RIG-I様受容体)
細胞質にある受容体がウイルス由来のRNAなどを感知し、ウイルス感染を別のタンパク質に伝える。それを受けたタンパク質は別のタンパク質に次々と情報をリレーし抗ウイルス応答を誘導する。
2.生きるか死ぬか、細胞の選択
ウイルス感染の初期にはたらく自然免疫系で中心的な役割を担うのが、タンパク質Ⅰ型インターフェロン(IFN)を介した応答である。感染細胞はⅠ型IFNを産生、分泌して周囲の細胞に抗ウイルス活性を与えるとともに、自らもⅠ型IFNの受容によって抗ウイルス状態となる。こうして、周囲の細胞への感染拡大と感染細胞内のウイルス増殖を抑制するのである。実際、Ⅰ型IFNを受容できないマウスは、野生型に比べてウイルス増殖が亢進し、早く死に至ることが報告されている。
個体では、様々な生理的あるいは病理的な状況下で細胞死がみられるが、ウイルス感染も細胞死を誘導することがある。ウイルスは侵入した宿主細胞がもつ増殖機構を使って複製、増殖するので、感染細胞の自死は、周囲の細胞への感染拡大を抑制し個体の生存に有利にはたらくことになる。多くのウイルスがその短いゲノム上に細胞死を抑制する因子をコードしていることからもそれはわかる。
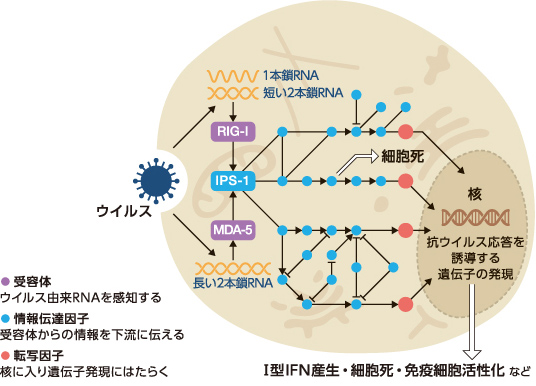
ところで、Ⅰ型IFN産生と細胞死という2つの抗ウイルス応答(図2)は、ともに個体に不利益を与える場合がある。Ⅰ型IFN産生が細菌感染に対する免疫応答を抑制する場合や、細胞死が組織損傷を誘導する場合などがその例である。そこで細胞は、個体にとって諸刃の剣であるこれら2つの応答を状況に応じてうまく使い分けているはずである。しかしその機構はこれまでほとんど解明されてこなかった。
(図2) 感染細胞の抗ウイルス応答
ウイルス感染細胞はⅠ型IFNの産生や細胞死の誘導などにより個体をウイルス感染から守る。
3.2つの応答を決める鍵
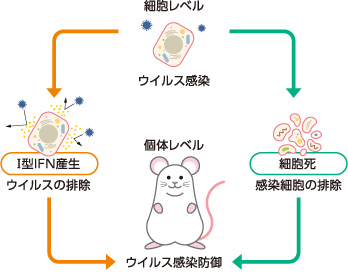
私たちはまず、ウイルス感染細胞におけるⅠ型IFN産生機構の解明を目指した。ウイルスを感知する代表的な受容体は、RIG-Ⅰ様タンパク質群(RLRs)である。これが、宿主にはないウイルス由来の一本鎖RNAや二本鎖RNAなどを感知すると、ミトコンドリア膜上に局在するタンパク質IPS-1と複合体を形成して抗ウイルス応答を誘導する。RLR-IPS1からの情報伝達には多数のタンパク質が複雑に関わり合っているのだが、その一端を担うタンパク質にアポトーシスシグナル調節キナーゼ1(ASK1)がある(図3)。
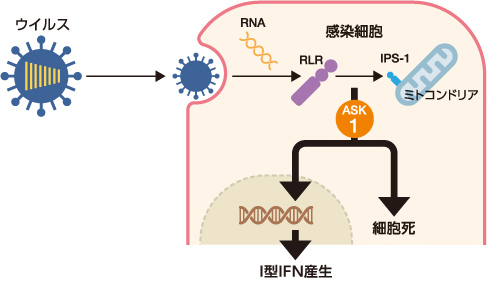
(図3) ウイルス感染細胞内ではたらくアポトーシスシグナル調節キナーゼ1(ASK1)
ASK1は、RLR-IPS1複合体からはじまる情報伝達の上流に位置する。
ASK1は、細胞がある種のストレスにさらされた際に応答することが知られているので、ASK1欠損マウスにインフルエンザウイルスを感染させ、肺でのⅠ型IFN産生遺伝子(IFNB)のはたらきを調べた。すると、野生型に比べてIFNBの転写誘導が4分の1程度に抑制されていることがわかった。つまりIFNBの発現には、ASK1が必要なのである。
次に、ASK1と細胞死の誘導との関係をみた。インフルエンザウイルスに感染したマウスの肺の気管上皮細胞では、酵素カスパーゼの活性化によって細胞死が引き起こされる。そこで、ASK1欠損マウスのカスパーゼ活性を野生型と比較したところ低下が認められ(図4)、ASK1はウイルス感染による細胞死の誘導にも必要なことがわかった。
さらに、ASK1が個体のウイルス防御を担っていることを確認するため、ASK1欠損マウスの肺でインフルエンザウイルスを定量したところ、野生型に比べ2倍以上に上昇していた。これらの結果から、ASK1はウイルス感染によるⅠ型IFN産生と細胞死誘導の両方を仲介する鍵であることがわかった。
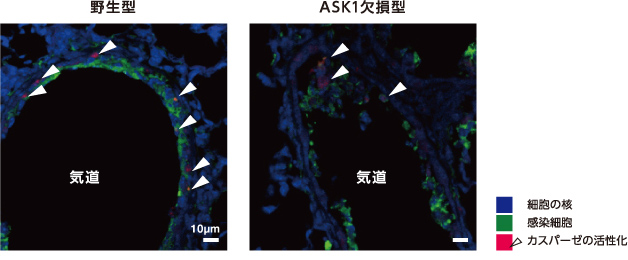
(図4) インフルエンザウイルスに感染したマウスの肺の気道を囲む気管上皮細胞(ASK1欠損型)
ASK1欠損型では野生型に比べカスパーゼが活性化した細胞(矢印)の割合が減少した。
4.ASKタンパク質群のはたらき
ASK1は安定したタンパク質で、細胞内でASK1同士が結合したホモ重合体(註)として存在し、情報伝達物質としての活性をもっている。この他、ASKタンパク質群にはASK1と高い相同性がありながら単独では非常に分解されやすいASK2が存在し、これはASK1とヘテロ重合体(註)を形成することで初めて安定になり活性をもつ。
そこで次に、ASK2のはたらきを調べた。ASK2欠損マウスにインフルエンザウイルスを感染させ、肺でのIFNBの発現をみたところ、野生型と同程度に誘導された。一方、カスパーゼの活性は野生型に比べ低下していた(図5)。これは、ASK2がウイルス感染による細胞死に選択的にはたらくことを示している。さらに、ASK2欠損マウスの肺におけるインフルエンザウイルスを定量したところ、野生型に比べ約3倍上昇していた。ASK2を介した細胞死の誘導は個体のウイルス防御に欠かせないと考えてよいだろう。
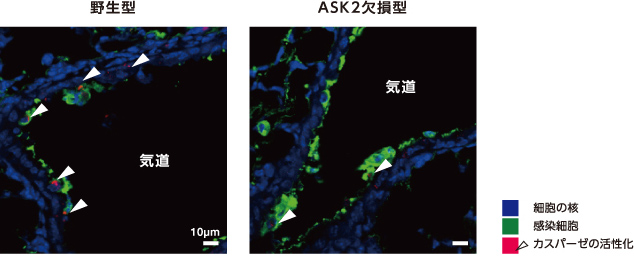
(図5) インフルエンザウイルスに感染したマウスの肺の気道を囲む気管上皮細胞(ASK2欠損型)
ASK2欠損型では野生型に比べカスパーゼが活性化した細胞(矢印)の割合が減少した。
こうして、ASK1はⅠ型IFN産生と細胞死の両方に、ASK2は細胞死のみに関与し、ASK1ホモ重合体がⅠ型IFN産生を、ASK1/ASK2へテロ重合体が細胞死を制御することがわかった(図6)。これまで謎が多かった抗ウイルス応答の使い分けを明確に示せたと考えている。
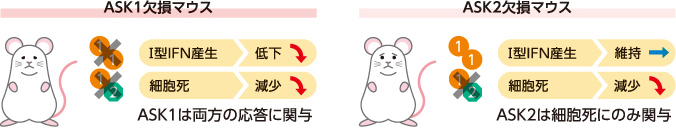
(図6) 実験結果のまとめ
(註) ホモ重合体、ヘテロ重合体
ホモは「同じ」、ヘテロは「異なる」を意味し、古代ギリシア語の接頭辞homoとheteroに由来する。同じ分子が結合したものをホモ重合体、異なる分子が結合したものをヘテロ重合体と呼ぶ。
5.組織における利益と不利益のバランス
ASK1は様々な組織に一様に存在しているのに対し、ASK2は損傷時に修復の早い肺や皮膚などの上皮組織で特に多く、修復の遅い脳や心臓などの非上皮組織では少ないことが知られている(図7)。代替のきく上皮組織ではASK2を介した細胞死の誘導により効率よくウイルスを排除し、それ以外の組織では主にⅠ型IFN産生による抵抗を優先するという機構によって、個体レベルの恒常性が保たれているのではないだろうか。
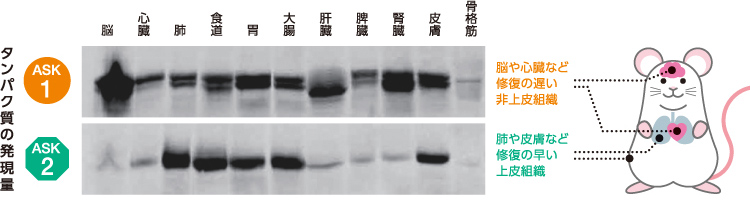
(図7) 異なる組織でのASK1とASK2のタンパク質発現量
マウスの組織からつくったタンパク質抽出液を電気泳動した写真。黒色のバンドがはっきりしているほど発現量が多い。
Iriyama et al., ASK1 and ASK2 differentially regulate the counteracting roles of apoptosis and inflammation in tumorigenesis. The EMBO Journal 28, 843-853 (2009).
EMBOより許可を得て改変
「生きるべきか、死ぬべきか…」。異なる組織の細胞にⅠ型IFNの産生か細胞死の誘導かという運命の分かれ道を示すASK2の存在は、ハムレットに自らの死を決意させた劇中の旅役者を想起させる。ウイルス感染による細胞死の誘導は、Ⅰ型IFN産生経路に比べて解析が遅れている。個体にとってⅠ型IFN産生の不利益が大きい状況では、ASK2を介した細胞死の誘導が有益になるだろう。私たちは、異なる組織におけるASKタンパク質群のはたらきを調べることで、ウイルスと戦いながら生き続ける生きものの巧みなしくみの解明を目指している。

岡崎朋彦(おかざき ともひこ)
2006年東京大学工学部卒、2013年東京大学大学院工学系研究科博士課程修了。博士(工学)。東京大学分子生物学研究所特任助教などを経て、2015年より同大学院薬学系研究科助教。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)
.jpg)
.jpg)