自己複製を支える核の大きさを制御するしくみ
久米一規
広島大学
自己複製は生きものの特徴の一つです。生きものの基本単位である細胞の分裂は細胞膜を区切って2つに分け、それに伴い細胞内の小器官を復元して再配置します。私たちヒトを含めて多くの真核生物の細胞の中心にある核に注目すると、その大きさは細胞サイズと比例関係にあり、単細胞真核生物の分裂酵母では細胞周期を通して核の大きさを細胞全体の8%で維持しています。一方、がん細胞や老化した細胞では核の肥大化が観察されることから、細胞の大きさに対して核を適切な大きさに保つことが生命維持に必要な代謝や化学反応を可能にしていると考えられます。しかし、何が最適な核の大きさを決め、どのようにして最適な大きさを維持しているのかは明らかではありません。生きものの基本単位、細胞の自己複製を支える核の大きさの研究について紹介します。
1.自己複製における核の大きさを制御することの重要性
生きものの本質の一つに「自己複製」がある。真核生物の細胞内には核やミトコンドリアなど、膜で仕切られた細胞小器官が多種類存在し、多彩な細胞機能を発揮するうえで重要な役割を担っている。分裂後の新生細胞で、それぞれの細胞小器官が独自の機能を発揮するためには、正しく分配され、細胞内で適切な大きさを維持する必要があり、細胞の大きさに合わせた巧みなサイズ調節メカニズムの存在が予想される。細胞内で遺伝情報を収納・保護する核は生命継承に重要な細胞小器官であり、その大きさは単細胞生物から多細胞生物にいたるほとんどの真核生物で細胞の大きさに比例して変化することが知られている(図1A)。核の大きさを評価する指標として、核の大きさ(Nuclear volume)を細胞の大きさ(Cellular volume)で割った値であるN/C比に着目した研究から、分裂酵母では細胞の大きさや核の中のDNAの量の変化とは関係なく、N/C比は細胞周期を通して0.08の定置(核は細胞の体積の8%)をとることが確かめられた(図1B)。しかし、細胞にとって最適なN/C比が何によって決定され、核サイズがどのように制御されるのかは不明であり、生物学における長年の大きな謎である。私たちはこの謎を解明するために、分裂酵母に存在する約5,000の遺伝子のうち、遺伝子をはたらかなくしても生存できる約3,000の遺伝子変異株や複数の温度感受性変異株を用いて、N/C比が異常値を示す変異体を探索した。その結果、見つかった変異体を調べると、脂質代謝が異常なものとmRNAの核外輸送が正常にはたらかないものであった。
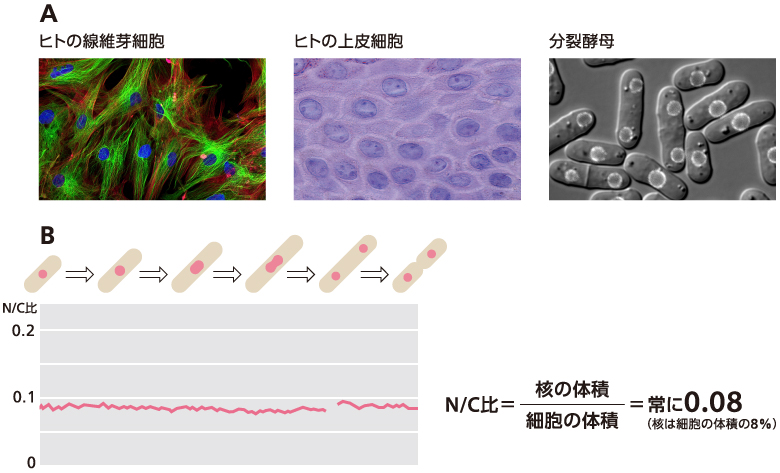
(図1)核の大きさは制御されている
A)細胞の大きさに比例して核の大きさは巧みに調整されている。
B)分裂酵母は細胞周期を通してN/C比を0.08(核は細胞の体積の8%)で維持している。
2.脂質代謝の異常による核の肥大化
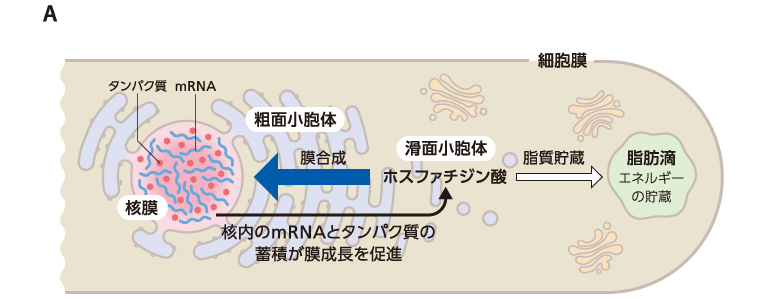
細胞内で脂質が合成される主要な場所は滑面小胞体である。核膜や細胞膜など細胞を構成する膜の構造リン脂質の供給源であるとともに、貯蔵脂質の合成も担っている。細胞は栄養条件に応じて、脂質代謝を制御しており、特に、細胞内の脂質源であるホスファチジン酸を膜の成長に用いる構造リン脂質とエネルギー貯蔵のための貯蔵脂質の合成のバランスを制御することが重要である。その分岐点で脂質代謝を制御しているのがLipinと呼ばれるタンパク質である。真核生物が共通してもつタンパク質であり、ホスファチジン酸を変換して貯蔵脂質の合成を促している(図2A)。核サイズの異常を示す変異体の探索で、このLipinのはたらきを制御するタンパク質であるNem1の機能が失われた変異体(以降nem1変異体)が見つかった。核の肥大化によりN/C比が0.096まで増加したうえに、核の形態も異常であった。nem1変異体では、Lipinが正常にはたらかず、脂質代謝が常に膜の成長に用いる構造リン脂質を合成する方向へと傾く。その結果、小胞体が肥大するため、小胞体と膜でつながった核にもその影響がおよんで核への膜供給が過剰になり、核が肥大したと考えられる(図2B)。

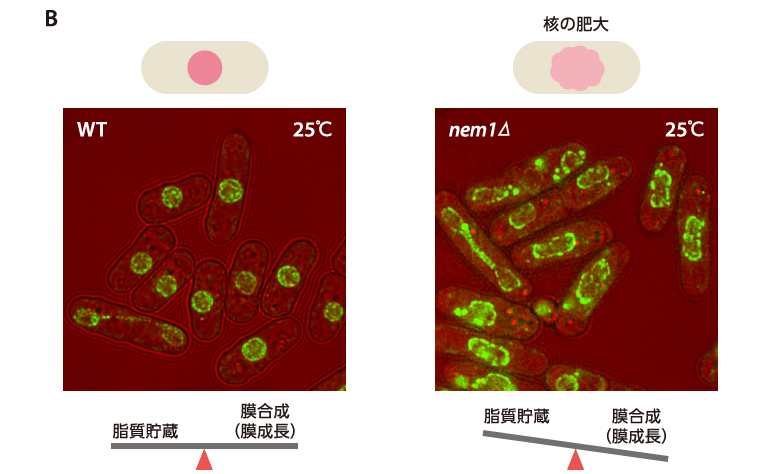
(図2)脂質代謝異常によって起こる核の肥大化
A)脂質代謝。滑面小胞体では、細胞の栄養条件に応じて膜成分となる構造リン脂質とと貯蔵脂質をバランスよく合成する。Nem1はLipinのはたらきを制御し、Lipinが活性化すると脂質代謝は貯蔵脂質合成の方向へ傾く。
B)脂質代謝の異常(nem1変異)により、膜の合成が促進された結果、小胞体と膜でつながった核への膜供給が過剰になり、核は肥大化し、異常な形態をとる。
3.mRNAとタンパク質の核外輸送の異常による核の肥大化
核は、DNAを転写し、タンパク質の鋳型となるmRNA合成の場として重要である。mRNAの核外輸送が破綻した変異体(以降rae1 変異体)細胞では、核の成長速度が野生株(N/C比 = 0.08)と比較して、約2倍に速くなったことにより、核が肥大化してN/C比が0.125まで増加していた。さらにこの原因は、核外輸送されずに核内に蓄積したmRNAとタンパク質であることがわかった。膜で覆われた細胞小器官である核が肥大化するためには、核内蓄積したmRNAやタンパク質に加え、核への膜供給が必要である。そこで、rae1変異体細胞で、膜成分となる構造リン脂質の合成を阻害したところ、核の肥大化が抑えられた。このことから、核外輸送の異常によって起こる核の肥大化も、脂質合成に依存した核への過剰な膜供給が原因であると考えられる(図3A,B)。
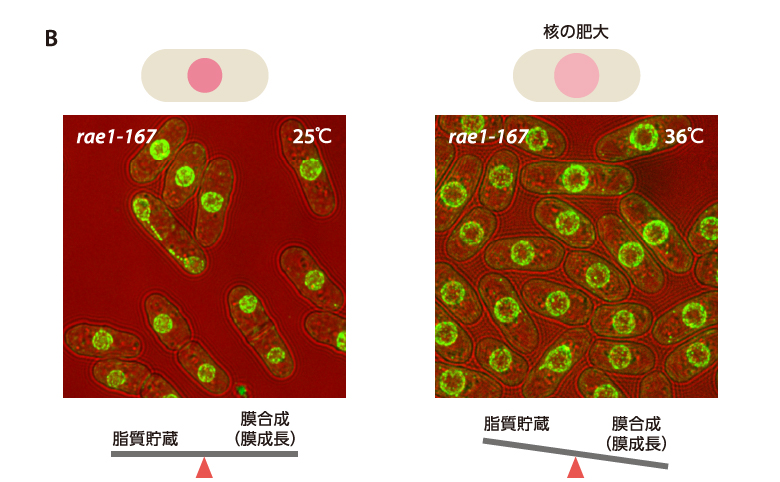
(図3)核外輸送の異常によって起こる核の肥大化
A) 核外輸送されるmRNAが輸送されずに、核内にmRNAとタンパク質が蓄積したことが核サイズの成長を促進する引き金となり、核の肥大化が誘導されたと考えられる。
B) 核外輸送の異常(rae1変異)により、膜の合成が促進された結果、核への膜供給が過剰になり、核が肥大した。
4.核膜の流れを制御するLem2タンパク質
これまでに高等生物の核サイズ制御には核の内側に存在するラミンタンパク質が関わることが報告されているが、植物や酵母にはラミンタンパク質は存在せず、普遍的な核サイズ制御の解明にはいたっていない。前述の核が肥大化した変異体では、核への脂質膜の過剰な供給が核の肥大化を引き起こすことがわかった。しかし、小胞体で合成された脂質膜が、核、ゴルジ体、細胞膜などにどのようにして適切な量を供給して、それぞれの大きさを適切に維持しているのだろう。膜で構成された、核、小胞体、ゴルジ体や細胞膜は、細胞内で互いに膜のやりとりをしているのかもしれない(図4)。
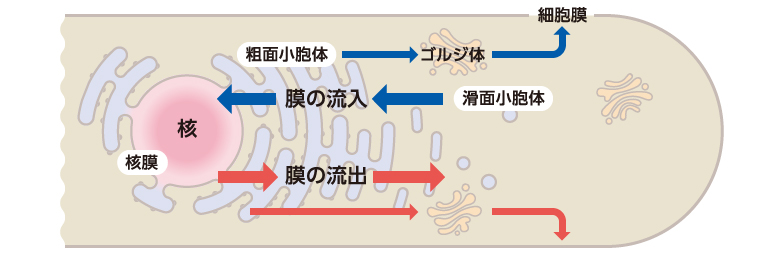
(図4)細胞内の動的な膜のやりとり
細胞内の細胞膜、ゴルジ体、小胞体、核は全て脂質膜で構成されており、細胞内で互いに膜のやりとりをしている。
私たちは核での膜のやりとりを介した核サイズ制御のしくみに迫るため、核膜タンパク質に着目した。分裂酵母に存在する核膜タンパク質について、その変異体のN/C比を測定したが、すべての変異体が約0.08の正常値を示した。では、核膜タンパク質は核の大きさの制御に関係ないのだろうか。そこで、それぞれの核膜タンパク質と先述のrae1変異体との二重変異体でN/C比を調べたところ、核膜タンパク質の中でも、進化の過程で高度に保存されたタンパク質Lem2のはたらかない二重変異体(lem2 rae1変異体)において、膜の過剰供給がrae1変異体よりもさらに促進され、顕著な核の肥大化がみられた。一方で、N/C比が増加する2種類の変異体(rae1変異体とnem1変異体)を用いて、Lem2の量を約2倍に増やしたところ、N/C比の増加を抑えることがわかった。これらの結果から、Lem2は、rae1変異などによって引き起こされる核への過剰な膜の供給(流入)を抑えることが示唆された(図5A)。次に膜の成長に必要な脂質の新規合成を阻害した場合のN/C比を、野生株とlem2変異体株とで比較した。その結果、両者とも成長に伴い細胞の大きさは増加しているにも関わらず、lem2変異体の核は縮小し、N/C比が0.02まで減少した。これは、細胞の成長に必要な細胞膜を供給するために核膜が流出したことが原因だと考えられ、Lem2は核膜の流出を制御する(=核膜を保護する)はたらきもあることが示された(図5B)。以上の結果から、Lem2は核と小胞体の間の膜の流れを制御する機能をもち、核サイズを維持する上で重要な役割を担うと考えられる(図6)。
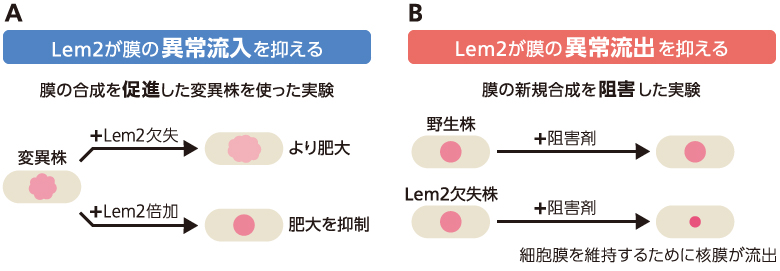
(図5)Lem2タンパク質の機能解析
A)脂質代謝変異で脂質膜の合成が促進されたことによる核の肥大化が、Lem2の欠失(=変異)で促進され、Lem2の二倍体で抑制された。
B) Lem2欠失(=変異)株で脂質膜の新規合成を阻害すると、核が縮小した。細胞膜の成長に必要となる脂質膜をまかなうために核から膜の流出が起こったと予想される。
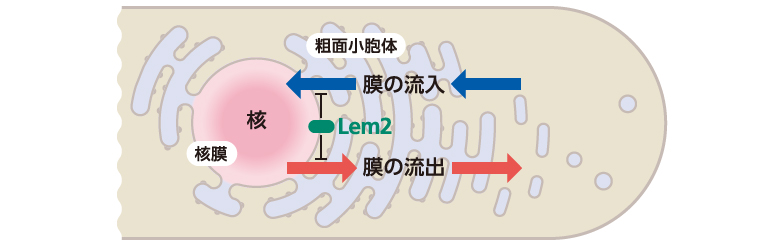
(図6)Lem2は核と小胞体の間の膜の流れを制御し、核サイズを維持する上で重要な役割を担う
5.小胞体膜の流れの制御も核の大きさの制御にはたらく
これまでにLem2の機能を補うタンパク質として、Lnp1が知られていた。Lnp1もまた酵母からヒトまで高度に保存されたタンパク質であり、小胞体に局在し小胞体膜構造の安定性に関わる。Lnp1の膜の流れにおける役割を調べるため、Lnp1の量を約2倍に増加させると前述のN/C比が小さくなるlem2変異体(+脂質膜合成阻害)の核の縮小を部分的に抑えることができた。またLnp1の発現量の増加は、Lem2の時と同様、nem1変異体細胞が示す核の肥大化を抑制した。さらに野生株細胞でLnp1を過剰に発現させるとN/C比は0.08から0.06まで減少した。以上のことから、Lnp1は小胞体において核への膜の流れを制御することがわかった。核の大きさは核への適切な膜供給を制御するしくみに幾重にも守られていると言えるだろう(図7)。
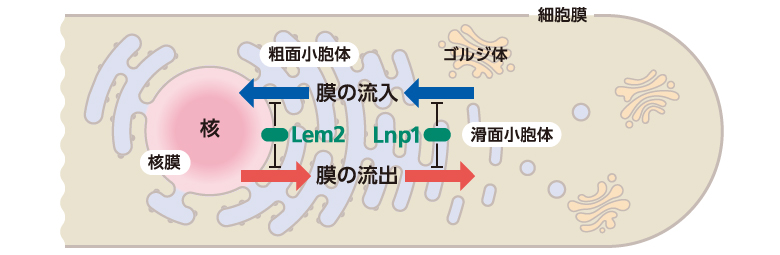
(図7)核の大きさは核膜の適切な供給を維持するしくみに幾重にも守られている
6.核サイズ研究のこれから
N/C比に着目した私たちの研究から、核サイズに影響をおよぼす因子を同定し、核肥大化のメカニズムの一端が明らかになりつつある。さらに核と小胞体それぞれの細胞小器官において核サイズ制御に重要なタンパク質を同定した。細胞がこれら2つのタンパク質を適切な量で配置することにより、核と小胞体を含むその他の細胞小器官との間で膜の流れを制御し、核への適切な膜供給を可能にしていると考えられる。このシステムは、核が細胞サイズと比例関係を保つうえで重要なメカニズムかもしれない。今後私たちは、膜の流れを制御するタンパク質による、核とその他の細胞小器官との膜輸送メカニズムの実態を分子レベルで明らかにし、細胞がいかにして核サイズを決定し、適切なサイズで維持しているのか?その答えに迫りたい。

久米一規(くめ・かずのり)
2007年 広島大学大学院先端物質科学研究科 博士課程修了。博士(理学)。同研究科助教、英国癌研究所(現 フランシス・クリック研究所)客員研究員(併任)を経て、2019年より広島大学大学院統合生命科学研究科 准教授。写真:私(本人左)の核サイズ研究でなくてはならない存在のPaul Nurse先生(フランシス・クリック研究所 所長)と。
細胞の進化・生きものの条件
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)

.png)