SYMPOSIUM
基調講演
基礎科学の発展を願って
1.あまり人がやらないことをやろう
皆さん、今、新型コロナウイルス感染症によるパンデミックの中で、生活の上でも、さまざまな影響を受けておられると思います。RNAワクチンの迅速な実用化などの明るい話題もありますが、同時に未解決の問題がたくさんあることを私たちは思い知らされました。私自身、自分がいかに人間の歴史の中の存在であるかということを強く感じることとなりました。今日は、そのような思いから「基礎科学の発展を願って」という題でお話しをさせていただこうと思います。
私は1945年生まれで、まさしく日本の戦後を生きたことになります。なぜ生物学者になったかと言えば、私が大学に入った1963年は、その前年のワトソン・クリックのノーベル賞受賞に象徴されるごとく、分子生物学のセントラルドグマ確立期の只中にあり、そのような時代を背景に大学生活を送ることになりました。私も生命の本質に興味を抱き、将来は、分子生物学をやりたいと思うようになりました。大腸菌というバクテリアを使って進められた分子生物学の黎明期は、生命の基本原理を明らかにしようという時期でしたが、やがて60年代後半になると、同じ単細胞でもバクテリアから真核細胞へ、つまり核を始めとする複雑な構造を持つ細胞へと関心が少しずつ広がり、それに伴い生体膜に興味が持たれる時代に大学院を過ごすことになりました。
生命の基本単位は細胞です。細胞が発見され、細胞は細胞からのみ生まれてくるという細胞説が唱えられた19世紀に、細胞が生命の基本単位だと理解されるようになったわけです。そして、細胞の中には、核やミトコンドリアなど、さまざまな膜構造があることが分かってきました。膜に加えて、細胞に欠かせないもう一つの成分はタンパク質です。皆さん、学校教育では、タンパク質を栄養素の一つとして習いますが、生物学者にとっては、まさしく生命機能を担う、あらゆる生命活動に重要な分子です。タンパク質は、20種類のアミノ酸が鎖状につながった高分子です。DNAに4種類の文字で書かれた私たちの遺伝暗号とは、どのタンパク質を、いつ、どこで、どれだけ作るかの情報であったという、これがセントラルドグマとも呼ばれた生命の基本原理でした。
地球上のあらゆる生物は、これら20種類のアミノ酸の組み合わせによって多様なタンパク質を作り出しています。このことは、地球上の生物は一つの共通祖先から派生したことを示す根拠の一つと考えられています。もう一つ重要なのは、生体膜です。細胞が成立する時、自分と環境とを分ける境界が必要ですが、地球上の生物は共通して、ここに示すような脂質二重層という薄い脂の層によって水の層を分離します。生体膜は、生命の誕生を可能にした重要な構造です。生体膜は、細胞自身と外部とを分けるのみならず、細胞の内側にも発達して、細胞の中を複雑に区画化しています。すべてのタンパク質は、細胞質にあるリボソームという構造上で作られますが、ここ20年ほどで細胞生物学者が明らかにしてきたこととは、細胞内で作られるタンパク質は、さまざまな膜構造によって巧妙に包まれ、分別され、細胞内の各所に運ばれ適材適所に機能することです。この中で、まだ明らかでなかったことに、タンパク質はどのように一生を終え、分解されていくのかという問題があります。
私は、写真にあるような酵母、皆さんも毎日パンを食べると何グラムかは口にしている、非常に身近な微生物である酵母(Saccharomyces cerevisiae)という細胞ともう四十数年つき合ってきたことになります。有用微生物であると同時に、優れた真核生物のモデルとして研究され、これまでに解明されたさまざまな知見が蓄積している生物でもあります。酵母は、細胞周期や分泌など、これまでノーベル賞の対象になったさまざまな生命の基本原理を明らかにする研究に貢献してきた生物です。
写真(写真1)は酵母の切片像です。私は3年ほどのアメリカ留学の後、東京大学の理学部へ戻った時、植物学の安楽先生に、酵母を使って何をやってもいいと言っていただく幸運に恵まれました。そこで私が、酵母で何を研究しようと思ったかというと、写真に写っている何の変哲もない球形をした液胞というオルガネラを調べようと思ったのです。当時、液胞は、植物細胞の中にある“ゴミ溜め”くらいにしか認識されていませんでした。人々が興味を示さない液胞には、きっと思いがけない機能があるだろうという期待を込めて研究を始めました。あまり人がやらないことをやろうという思いは、今も私の中で大事にしています。
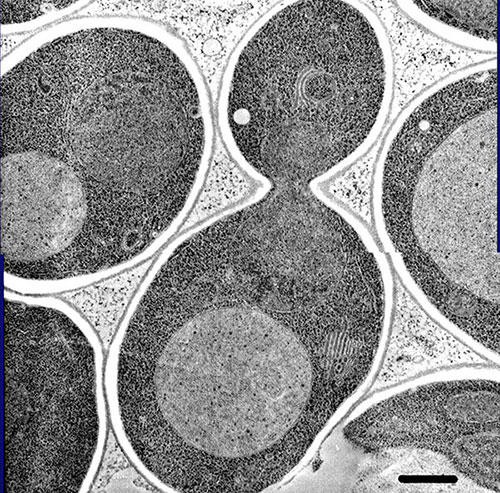
(写真1)
実験室で、酵母を培養しては、液胞という膜構造を取り出して調べるという日々から、その膜が、さまざまなアミノ酸や、カルシウムイオンを取り込む能動輸送の系をもっていることが見えてきました。液胞の内部は酸性になっており、水素イオンの濃度勾配を使っていろいろな物質を取り込む機能があるようだと考えて探った結果、VタイプATPaseと呼ばれる分子装置を明らかにすることができました。
この時期は、液胞というオルガネラが、さまざま物質を貯蔵するほか、いろいろな機能を果たしていることが明らかになる10年でした。私はよく若い人に、自然界には分かっているように見えて、実はまだ知られていない、面白いことがいっぱいあると言っています。樹木はあれほど大きく育ちます。竹のように1日で1メートル伸びるようなことは、人間では考えられませんね。その一つに、液胞というオルガネラが果たしている役割があるとも言えるのです。液胞の研究を続けて10年ほどが経ち転機が訪れました。’88年に、独立して自分一人の研究室を持つことになったのです。その時、液胞の研究から見えた次の課題として、液胞がもつ分解機能を実証するという新しい研究テーマを立てました。
当時、細胞内の分解は、あまり積極的な機能として捉えられていませんでした。タンパク質は細胞の中で壊れてしまうものであり、壊れたものを補充する必要からタンパク質は合成されているという常識があったように思います。でも、よく考えてみれば、すべての安定なシステムというのは、合成と分解との平衡関係にあるはずです。
現在社会もそうなっています。新しくビルを建設するには、古い建物を壊さなくてはなりません。今問題になっているプラスティックのゴミも、原発の例でも、使用済みの燃料を廃棄するだけでは安定なシステムにはならないという問題があります。分解とは、実は、大事なテーマなのだということがお分かりいただけると思います。
2.発見には、偶然と幸運が重なるもの
私は、この研究過程で、オートファジーという現象を解析しました。細胞が自分自身の成分を分解する機構です。まずは、どのようにしてこの問題に挑戦しようとしたかをお話しします。
当時、私は、東大教養学部の生物の授業を担当していました。高校から大学に入った最初の生物の授業を、いつも次のような「問い」から始めていました。「私たちの体の中で、わずか1秒間であっという間に何個の赤血球が作られるか計算してください」という問題です。幾つかの数値があれば計算は簡単です。赤血球は1秒間に私たちの体で300万個作られている。ご存知のように、赤血球は酸素を末端の組織まで運ぶように特化した細胞ですが、その中に赤く見えるヘモグロビンというタンパク質は、1秒間に10の15乗個、1000兆個作られていることになります。私がなぜ、こういう計算から私の授業をスタートしていたか。それは生物学を学ぶ時、実は生物とは、とてもダイナミックに維持されている存在だということを認識して欲しいからです。
栄養学では、1日に70gほどのタンパク質を毎日取りなさいと学びます。ところが私たちの体の中では、1日におよそ200~300gのタンパク質が作られている計算になります。この2つの数値の差は、実を言うと、私たちの体を構成しているタンパク質の大半は、自分自身のタンパク質を分解してできたアミノ酸によって合成されている、私たちの体は、巧妙なリサイクルシステムであることを示しているのです。つまり生命とは、タンパク質の合成と分解の平衡によって成り立っているのです。
飢餓になるとすぐ死んでしまうようでは、その生物は進化過程で生き残れません。飢餓を凌ぐしくみは進化の上で獲得すべき重要な要因の一つであっただろうと考えられます。私たちが、1週間程であれば水を飲むだけで凌げるという事実は、まさしく私たちの体がリサイクルシステムを持っていることの傍証に他なりません。実を言うと、分解という現象は、当初、思われていたほど受動的でなく、かなり能動的な過程であり、生命にとって、合成と同じくらい重要であることが明らかになってきたというのが今日のお話のポイントです。
実は、細胞内でのタンパク質の分解という問題は古くからありましたが、なかなか前に進みませんでした。その歴史を振り返ると、1955年にクリスチャン・ド・デューブというベルギーの生物学者がリソゾームというオルガネラを発見したことに始まります。リソゾームは、膜で囲まれた内部は酸性で、その中にさまざまな分解酵素を含んでいました。リソゾームの内部で危険な分解反応が起きていると考えられ、細胞内のリソゾームが運ばれる経路の解析が、電子顕微鏡学者によって始まりました。
ロックフェラーのグループを中心にその過程が解明され、’62年、今から60年程前に、細胞自身の構成成分を液胞内に運び込むしくみとしてオートファジーが提唱されました。オートファジーとは、自分自身を食べる “self eating” のギリシャ語の造語です。
オートファジーは、私たちの体内でも頻繁に起こる現象です。しかし、この研究には、電子顕微鏡の解析が必須で、なかなかそれに関わる因子は解明されないまま時が流れていました。
私は、酵母の液胞が分解に関わっていると考えていました。しかし、細胞質中のタンパク質は、どのように生体膜を越えて液胞中の分解酵素に至るのでしょうか。いつ、どこで、何が液胞の中へ運ばれるのかという「問い」です。いつ、ということに関しては、私が以前から興味を持っていた酵母の胞子形成過程が一つのヒントになりました。酵母細胞は、アミノ酸に必須な元素である窒素源のない環境条件下では増殖をやめ、減数分裂によって胞子形成過程が誘導されます(写真2)。栄養不足だと細胞内を大きく作り替えるのです。その時、必要なタンパク質合成の原料は、自らのタンパク質を分解して調達するほかありません。
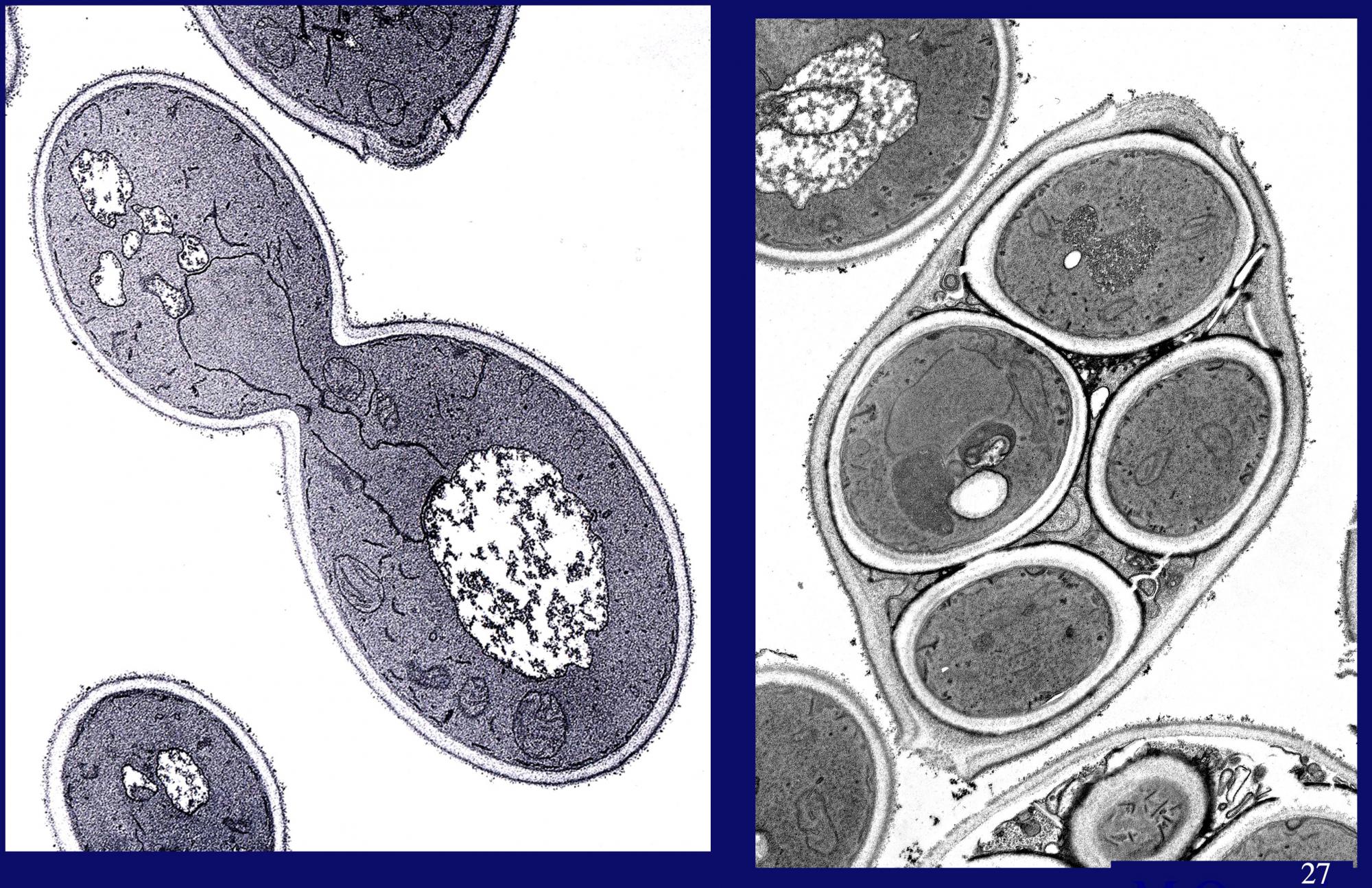
(写真2)通常の栄養増殖細胞(左)と、減数分裂によって胞子を形成する細胞(右)
さらに、液胞という何の変哲もない球形の構造は、比較的大きく、内部は塩の水溶液に近くタンパク質濃度が低いので、液胞内に入った構造は顕微鏡で簡単に観察することができます。これらのことから、飢餓状態下で胞子形成を行う酵母細胞で、液胞内の変化を、直接、観察できるかもしれないと考えたのです。
観察を始めたところ、最初は何の変化も認められませんでしたが、それは、分解がとても速く起きているからではないかと考え、液胞内の分解酵素のはたらきを止めることを思い立ちました。既にアメリカのエリザベス・ジョーンズが、液胞内の3つの分解酵素を欠いた変異株を作成していたので、これを用いて観察したところ、液胞内に球形の構造がぎっしり溜って、激しく動き回っている状態が観察されました(動画1)。発見には、偶然と幸運が重なるものです。これが、私のオートファジーの研究の出発点になりました。このように激しく動き回っていたからこそ、私は発見することができたのです。私は、大変、面白い現象に出くわしたと思いました。
(動画1)変異株が飢餓状態下に示す液胞の形態変化
この現象は、ここに示すように、30分経過する頃から、球形の構造が現れ、1時間、2時間とその数を増し、3時間程でぎっしりと液胞内に溜っていきます(写真3)。液胞内の球形構造の動きは、粘性の低い水溶液中でのブラウン運動ですが、このように動いていたからこそ、当時、私が持っていた顕微鏡でも確認することができたのです。早速、馬場美鈴さんという電顕学者と共同研究を始め、電子顕微鏡で、より詳細な過程を観察することしました。写真をご覧ください。液胞中に溜まった球形の構造の中に見える黒い点々は、細胞質のリボソームですから、細胞質の一部の領域が膜で液胞内に取り込まれているということになります(写真4)。たくさんの写真の中には、液胞近傍で膜の袋がカップ状に伸び出し、まさしく細胞質の一部を取り囲もうとしている様子も写っています(写真5)。細胞質中に、オートファゴソームと呼ばれる二重膜構造が形成されて、外側の膜が液胞膜と融合することで、内側の膜構造が液胞の中に放出されるのです。これが、私たちがオートファジックボディと名づけた球形構造であることが確認されました(写真6)。オートファジーという分解のしくみでは、一つの袋でリボソームを一度に何千個と分解し、ミトコンドリアのようなオルガネラを丸ごと取り込んで分解できます(写真7)。
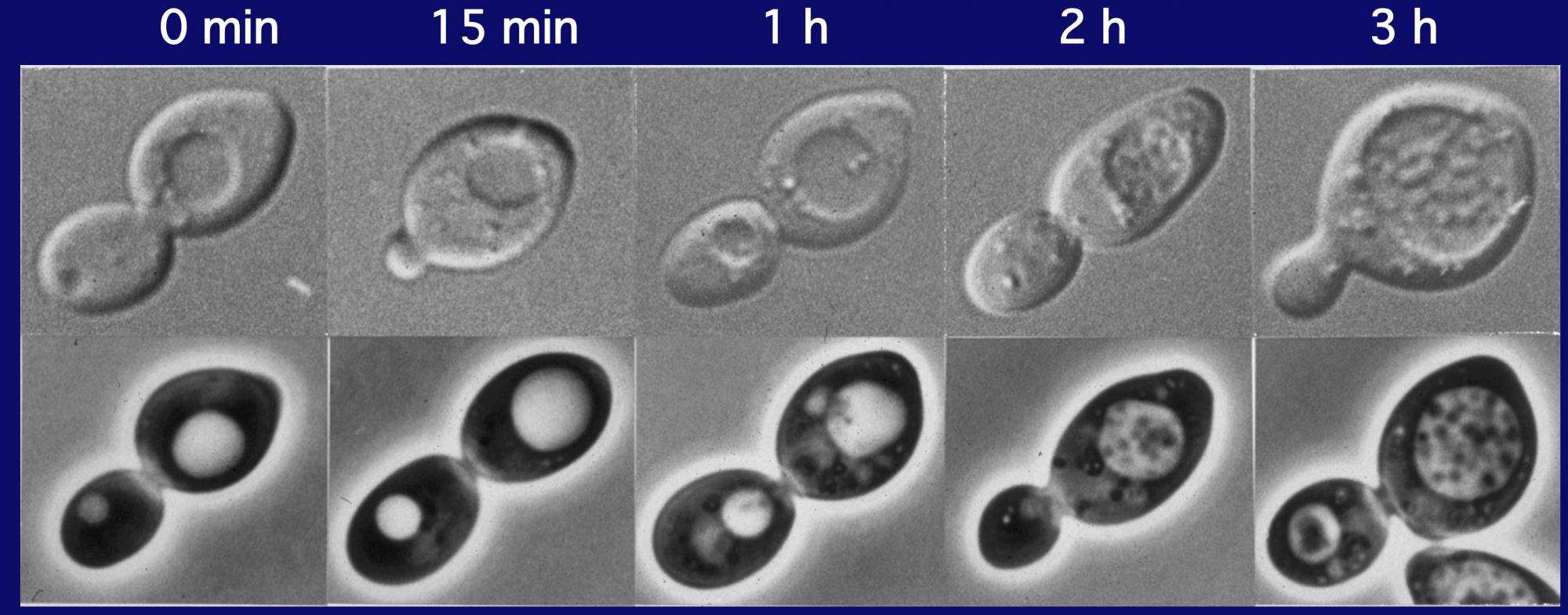
(写真3)液胞内に徐々に蓄積されるオートファジックボディ
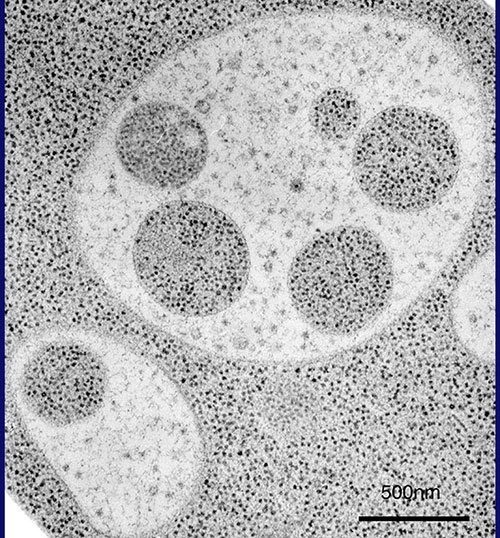
(写真4)
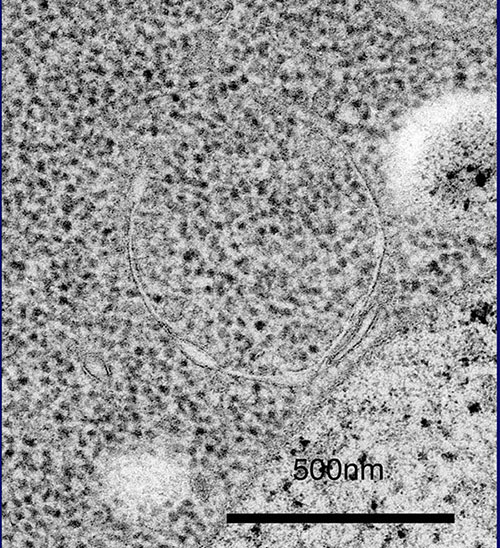
(写真5)
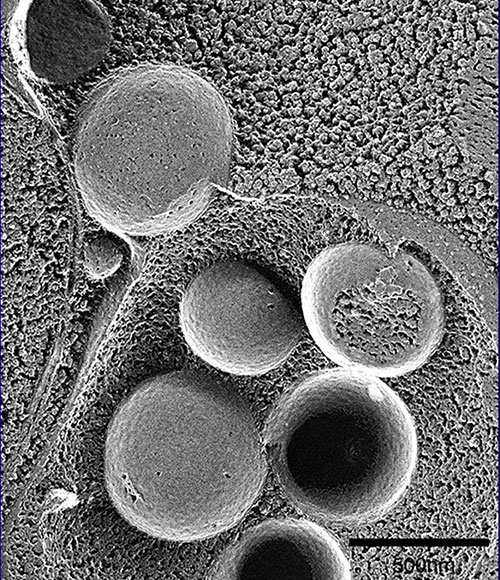
(写真6)
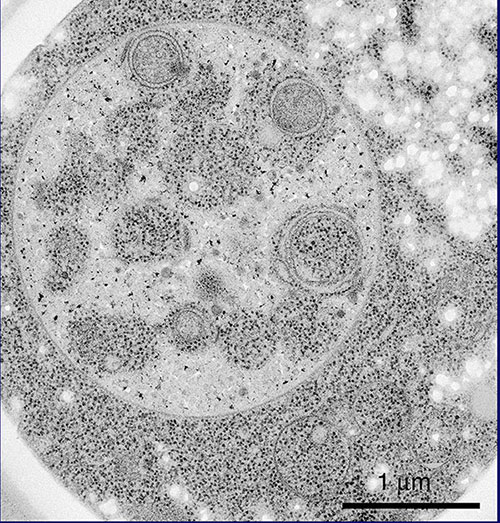
(写真7)
3.オートファジーはあらゆる生命現象に関わる
こうして私たちは、二十数年前に、オートファジーという現象を一枚の模式図に表すことができました(図1)。飢餓を感じた酵母細胞の内部に、突如として膜構造が現れ、細胞質の一部分を取り囲み、膜融合でそれを液胞へと送り込むのです。最初に、オートファジーとして提唱された動物細胞で分解を担うリソゾームは、大変小さなオルガネラですが、大きさの違いを除くと、私たちが酵母の液胞で解明した膜輸送は同じしくみであることが分かりました。酵母は、細胞の中で起こる膜現象を光学顕微鏡下に実時間で観察できるという特徴をもっています。私たちは、酵母がオートファジー研究のモデルになると考え、そこに関わる遺伝子を知るために、オートファジーができない変異株を取ることにしました。
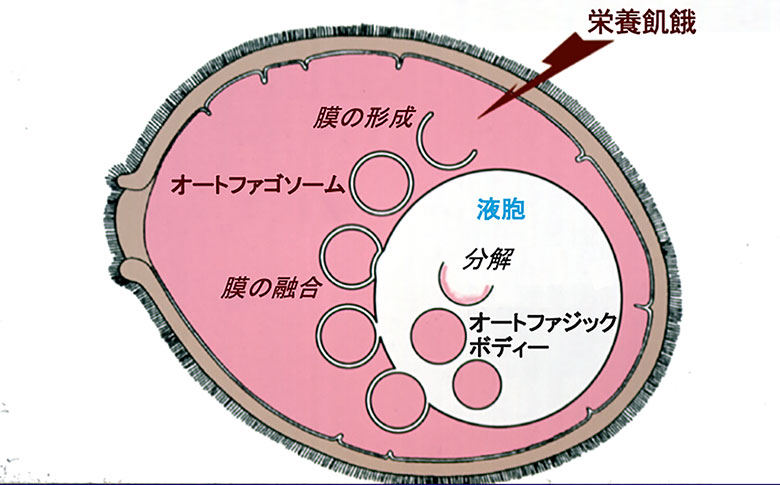
(図1)酵母細胞のオートファジーの模式図
私の研究室に最初に来てくれた修士の大学院生の塚田美樹さんが、顕微鏡下に、オートファジックボディが溜まらない形質のものを選別するという作業を1年余り続けて、変異株を取ってくれました。ここから私たちは、最初のスクリーニングで、酵母のオートファジーには少なくとも15個の遺伝子が関わることを明らかにし、ATGと名づけました。後の研究で必要な遺伝子は全部で18個あることが分かりました。ATG遺伝子は、いずれも細胞質中に、オートファゴソームと呼ばれる新しい膜を作る分子装置であることが明らかになりました。
次に、そのAtgタンパク質は、細胞内の、どこで、何をしているのかに、私たちの興味は移ります。幸い、下村脩先生が発見されたGFP蛍光タンパク質を特定のタンパク質に結合することで、細胞内のどこで、どのように振る舞うかを観察できます。例えばAtg17が、栄養飢餓状態下に、液胞近傍に粒状に集まる様子が観察され、そこからオートファゴソームが形成されると想像できます(動画2)。研究を重ねることで、私たちはAtgタンパク質が、6つの機能単位がはたらいて液胞上のPASと呼ぶ構造に集合し、膜を形成していく過程を理解し、その全体像を描き出すことができました。
(動画2)GFPを導入したAtg17遺伝子の発現。通常は、細胞質の中で激しく動いている(左)が、栄養飢餓下では、粒状に、液胞近傍に集まってくる(右)。
さらに私たちが酵母から発見したATG遺伝子は、その大半が、動物にも植物にも保存されていることが明らかになりました。この発見は大きな意味を持っています。電子顕微鏡でしか解析できなかったオートファジーの解析が、ATG遺伝子とその遺伝子産物を手掛かりに、その生理的機能を一気に解析することができるようになったのです。
例えば、マウスでGFPを導入したAtgタンパク質が、受精卵から発生を辿り、どの細胞で発現しているか。さらに筋肉、すい臓などの組織・器官で、オートファゴソームが形成される様子まで観察することができます。
また、酵母と同じように、動物細胞でもオートファジー遺伝子のはたらかないノックアウトマウスで解析できるようになりました。久万さん、水島さんらが、最初のオートファジーのノックアウトマウスの作成に成功しました。生まれてくるのですが、オートファジーがはたらかないマウスは12時間で死んでしまいます。哺乳類の生存に、オートファジーは必須なのです。
その後、肝臓など、ある器官でオートファジーの機能を失うとどうなるかという研究が始まり、今、順天堂にいる小松さんが、肝臓でオートファジーがはたらかないと肝臓ガンを生じ、細胞内に処理されないタンパク質が溜まってくることが分かりました。
神経系は、私たちの体で飢餓に応答しない唯一の組織ですが、実は、神経系はオートファジーに最も敏感な組織で、オートファジーがはたらかないと不要成分が細胞内に溜まって神経変性疾患様の病態を生じることが分かりました。阪大の吉森さんのグループは、オートファジーは細胞質に逃げ出したバクテリアを取り囲んで分解するということも発見しました。これは選択的オートファジーのよい例になりました。
オートファジーは、栄養をリサイクルし、細胞内に溜まった不要成分やオルガネラを取り除き、細胞の品質管理を果たしています。現在は、壊れたミトコンドリアやタンパク質を、どうやったら選択的に分解できるかということが大きな研究課題の一つになっています。ATG遺伝子からオートファジーを解析できるようになったことで、世界中で、いろいろな細胞、いろいろな生物でオートファジー遺伝子をノックアウトすると何が起こるかと、一挙にオートファジーの生理機能が調べられるようになりました。初期胚発生の卵細胞で母親由来のタンパク質がオートファジーによって分解されることが発生に必須であるとか、オートファジーは寿命に関係している、オートファジーはガン細胞の増殖に必須でガン抑制のターゲットとして重要など……あらゆる生命機能に関わるテーマとしてオートファジー研究が広がるようになりました。
オートファジー研究が広がった理由には、もちろんオートファジーという現象が、実際にさまざまな生命現象に関わっていることがあげられますが、もう一つ、話題性のあるものが論文としても通用しやすい科学の世界で、オートファジーが一種の流行になっているという背景があるように感じています。
オートファジー関連論文の推移を見ると、私が研究を始めた1988年頃は、論文数が世界中で約20本という静かな時代でした。ところが、昨年は1万本で、とてもすべてに目を通すことはできないくらいの研究分野に発展したわけです。
私の小さな疑問から始まったオートファジー研究は、30年の歳月を経て、今や多くの研究者が参入する分野に成長しました。ここで申し上げておきたいのは、一つの大きな研究分野が立ち上がるには、長い歳月が必要だということです。
そしてもう一つ、申し上げておきたいのは、実のところ、このような既存の大きな潮流に乗るよりは、まだ誰も目を付けてないところに自分の覚悟をかけてみるという若者が出てきてくれることを、私は、強く願っています。オートファジー研究も、まだ基本的な問題でオートファジーの検出法が確立してないとか、実は、まだオートファジーを定量的に扱う手法がないとか、未解明なことも多々あります。そのような状況の中で、私はずっと、酵母で研究してきました。私自身は、自分の実験系でまだ分からないことがたくさんあるのだから、まだ酵母とつき合いながら残された問題を解決するのが自分の歴史的な使命だろうと思って、酵母のオートファジーの研究を続けています。
最近、18個のオートファジー関連遺伝子の中で、これまで構造生物学で解けなかったAtg2とAtg9という2つのタンパク質の機能が解明され、それが、脂質の動態に関わっているという新しい発見につながりました。さらにオートファジーによって、タンパク質ばかりでなく、大量のRNAも分解されているという解析も進めています。
以上、駆け足でしたが、私の33年の酵母のオートファジーの研究を振り返りました。強調しておきたいことは、私は、医療への応用を目的に研究を始めたわけではありません。純粋に、細胞内でタンパク質を分解するしくみはどうなっているのだろうという「問い」からスタートした研究だということです。
4.科学研究はとても楽しい
私たちの研究から、たまたま遺伝子が分かり、それが大きな研究分野にまで成長した。このことは、世界中の多くの研究者の努力によって成し遂げられたことだと思っています。私が、これまで三十数年間、オートファジーの研究を続けてくることができた大きな理由は、ずっと素晴らしい研究室の仲間に恵まれ、共同研究者に恵まれてきたからだと思っています。そしてずっとオートファジー研究をサポートしてくれた社会も、今よりは、もう少しゆとりがあったのかなと思います。継続的に研究を続けるサポートを得られたことに感謝しています。
生物学周辺の技術開発は、コンピューターの発展などに支えられて大変なスピードで進み、顕微鏡一つをとっても、以前は見えなかったものが、手に取るように見えるようになり、タンパク質の詳細な構造を解析できるようになり、できなかったことが、次々とできるようになったという実感はあります。その一方で、研究とは、個人的な営みという側面もありますが、決して一人で達成できるものではなく、たくさんの研究者が集うことで一つの研究が進むということを忘れずにいて欲しい。とくに、いずれの研究も、次の世代の人が、それを乗り越え、書き換えていくものだということを、若い人には、とくに強調してお伝えしておきたいと思います。
科学研究はとても楽しい、と私自身は思っています。人類が、それまで知り得なかった「問い」に挑戦して、解くことができる。これは大きな喜びです。ぜひ、自分で抱いた小さな疑問を大事にして欲しいと思います。研究は、簡単に正解が得られるものではありませんから、研究者は、研究の過程そのものを楽しむことを大事にして欲しいと思います。現代の私たちは、自然に接する機会がとても減ってきています。同時に、膨大な情報に囲まれて、その中で何が正しい情報かと考える余裕がなくなっています。でも皆さん、ぜひ自分で考えてみるという作業を大事にして欲しいと思います。今、効率ばかりが要求される社会になってしまい、誰もが余裕を失っています。短期的な成果を重視するばかりに、研究に対しても、役に立つか否かが無条件に問われる状況があります。私は、研究者が、必ずしも、役に立つということを意識しなくてはならないとは思いません。むしろ、そのことで研究の視野が狭められることのないようにと願っています。
これから訪れる未来が、科学的なものの見方や、考え方を大事にして、それを楽しむ社会であって欲しいと願っています。すぐに応用に結びつくということではない、科学本来の基盤を大切にする社会であって欲しい。1年先、2年先でなく、10年後、あるいは自分の子の世代、孫の世代、50年後、100年後の人類の未来を考える、そのような視点を持つことを、とくに若い人たちに期待しています。
当日の記録動画をYouTubeチャンネルでご覧になれます。

大隅 良典(おおすみ・よしのり)
1945年、福岡市生まれ。1967年東京大学教養学部卒。74年理学博士。ロックフェラー大学博士研究員、東京大学理学部助手、講師、教養学部助教授を経て、1996年から岡崎国立共同研究機構(現自然科学研究機構)基礎生物学研究所教授。2009年に同研究所名誉教授、同年に東京工業大学特任教授、その後14年に同大学栄誉教授。
2006年日本学士院賞、09年朝日賞、12年京都賞を受賞、15年文化功労者、国際生物学賞。16年文化勲章。さらに同年「オートファジー」を解明した功績により12月にノーベル生理学・医学賞受賞。2017年 大隅基礎科学創成財団を設立。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)

.jpg)
.jpg)