RESEARCH
体内時計と分節時計
–2つの時計が刻むリズムの関係
地球上のほとんどの生きものの体には、生まれた時から、約24時間の時を知らせる体内時計が備わっている。地球環境で健やかに生きるために必要なこの機能は、生まれるまでの間に、どのように形成されるのだろう。
1. 体内時計と概日リズム
私たちの体には昼夜の環境変化に応じた約24時間周期のリズムがあります。これを概日リズムと呼びます。睡眠・覚醒リズムの他、自律神経や血圧、ホルモン分泌や代謝など、非常に多くの生理機能にはっきりとした概日リズムが見られます。このリズムを作り出しているのが体内時計です。体内時計は、地球の自転に伴う昼夜の環境サイクルに体の機能を適応させるしくみで、時計遺伝子と呼ばれる遺伝子群から作られた分子の量や質の周期的な変化を「時間」として見ることができます。
体内時計の要となる時計遺伝子はClock/Bmal1です。日中、CLOCK/BMAL1は転写因子として、PerやCryなどの時計遺伝子を発現させ、細胞質で翻訳された時計タンパク質PER/CRYは核に移動し、PER/CRYが増えるとともにCLOCK/BMAL1を抑制し、Per/Cryなどの時計遺伝子の発現を抑制します。これら分子の変化が、約24時間周期で繰り返されることで、概日リズムを生み出しているのです。(図1)
体内時計は、人間を含む哺乳類から、鳥類や爬虫類、両生類、魚類に至る全ての脊椎動物にあり、昆虫などの無脊椎動物、植物、アカパンカビやシアノバクテリアなど、地球上のほとんどの生物に備わっています。
長い間、哺乳類の体内時計は脳の視交叉上核にしかないと信じられてきましたが、1997年の哺乳類での時計遺伝子の発見以降、視交叉上核と同じようにさまざまな臓器や組織でも、時計遺伝子が発現リズムを刻むことが明らかになっていきました。体内時計は、全身の細胞がもつ普遍的な機能だったのです。(図1)
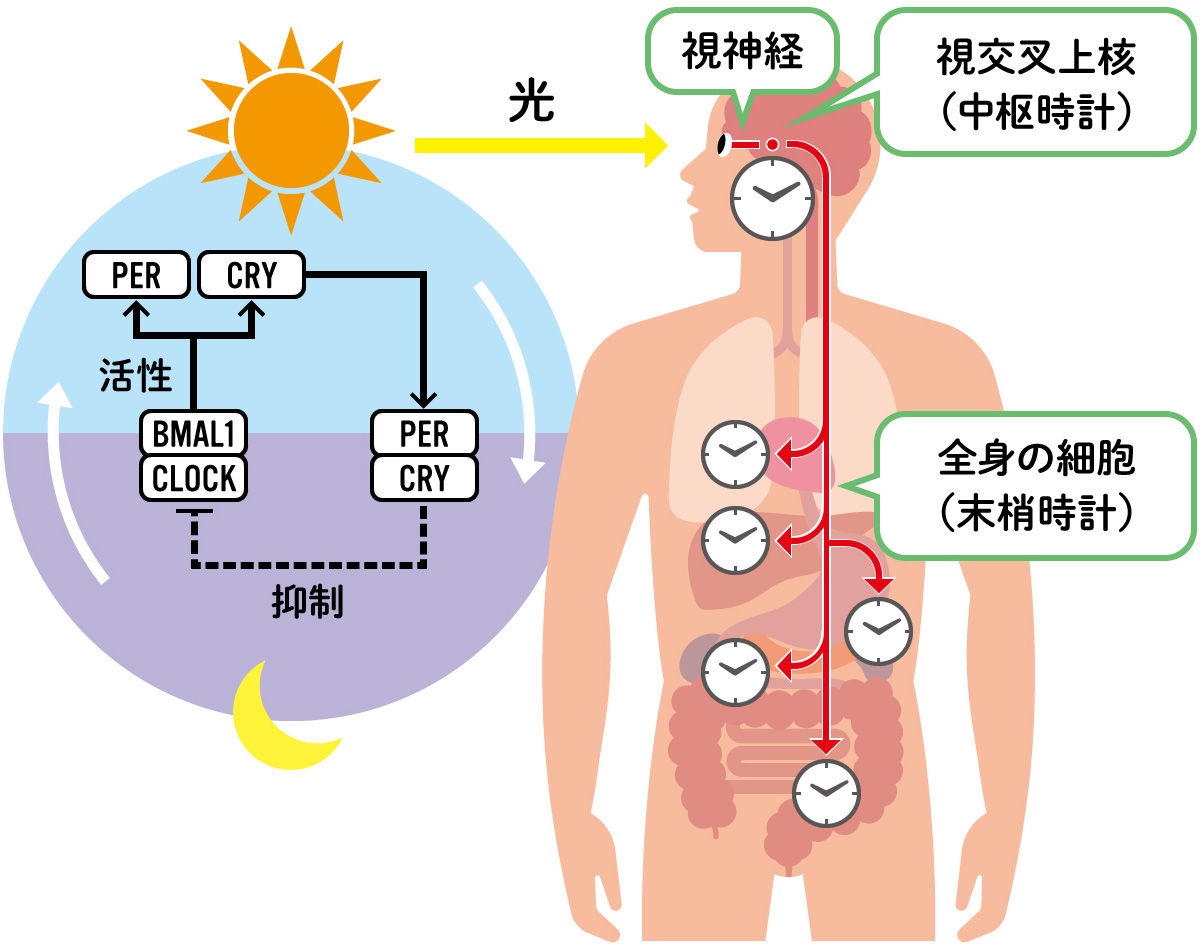
(図1) 全身の細胞に存在する体内時計
私たち哺乳類では、視神経で受け取った光情報が視交叉上核に入る。視交叉上核には体内時計の中枢の機能があり、末梢時計を制御している。
体内時計の時計遺伝子群からはタンパク質が作られ、これが過剰になると発現を抑えるフィードバックのしくみで細胞の中を安定させ、周期をもつ時計としてはたらくことができる。
2. 細胞が自ら生み出す体内時計
全身の細胞に体内時計がある一方で、例外的に精子を作る生殖細胞には体内時計がなく、マウスの発生初期胚でも時計遺伝子の発現にリズムが見られないことが知られていました。哺乳類は生後、全身の細胞に体内時計を備えているにも関わらず、発生過程のある時期まではリズムがなく、生まれるまでの間に形成されるようなのです。そこで私たちは、全く未知の領域でしたが、発生過程の細胞分化と体内時計の関係について研究を始めました。
まず、胚盤胞という初期胚に由来する多能性幹細胞のES細胞(胚性幹細胞)に着目し、ES細胞に体内時計があるか検討しました。時計遺伝子にホタルの発光遺伝子ルシフェラーゼを融合させた発光レポーターを用いて、遺伝子が発現すると発光するリズムを観察したところ、発光リズムは見られませんでした。体内時計の要となる転写因子CLOCK/BMAL1による時計遺伝子の発現制御が機能していないことがわかり、ES細胞に体内時計は存在しないことが示されました。
続いて、ES細胞を人工的に培養皿で分化誘導(註1)することで体内時計が形成されるか観察しました。幹細胞生物学の分野では、通常のES細胞の分化誘導は1週間程度の培養期間で、未分化状態(註2)の維持に関わる転写因子NanogやOct4などが完全に抑制され、分化した体細胞の性質を示すようになります。しかし、1週間後の細胞を観察しても体内時計のリズムが見られず、15日目で初めて明瞭なリズムが検出できました。体内時計の形成には、2週間以上の分化誘導期間が必要であり、また、外界の環境サイクルに依存せず細胞自律的に形成されることがわかりました。[コラム]
これとは逆に、ES細胞の分化誘導培養で形成された体内時計のリズムを確認した後、この細胞を初期化してiPS細胞にすると体内時計のリズムが消えました。さらに、このiPS細胞を再び分化誘導すると、また体内時計のリズムが確認できたのです。体内時計は細胞の分化状態によって形成されたり消えたりする、という哺乳類細胞としての普遍的な特性を明らかにできました。(図2)
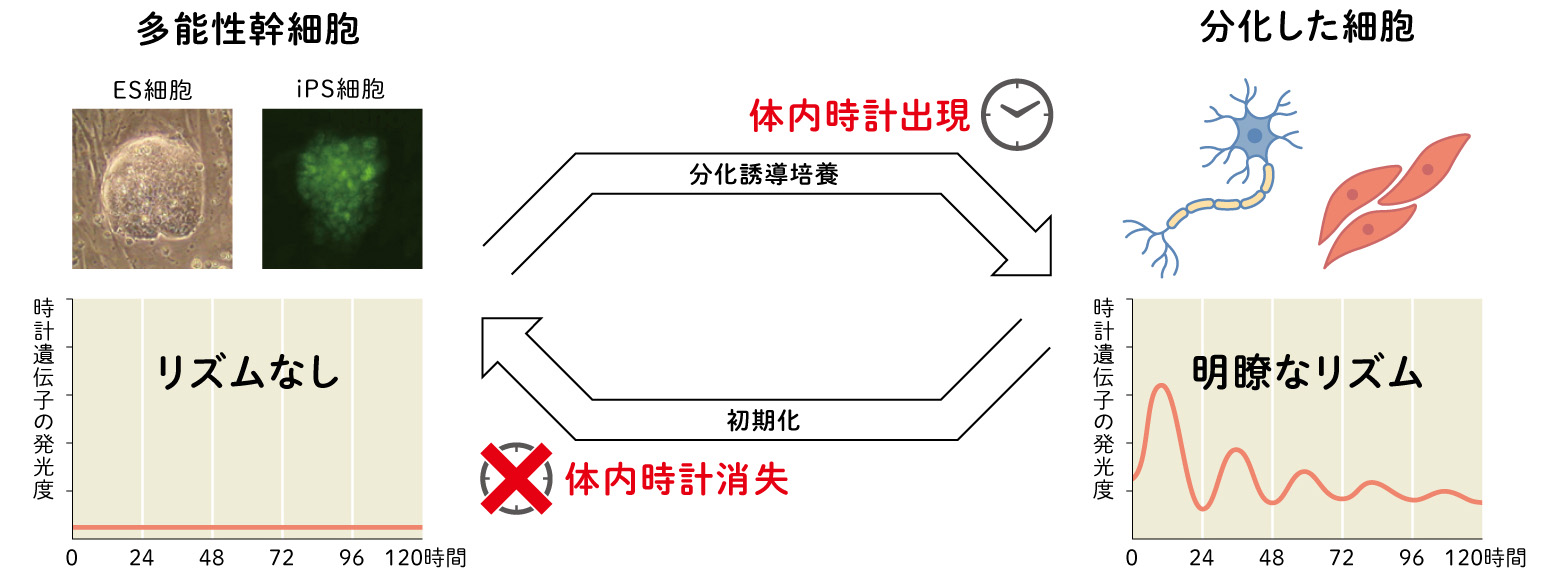
(図2) 体内時計とES細胞・iPS細胞
分化誘導に伴って細胞自律的に体内時計が出現し、逆に初期化すると体内時計が消失し、これを繰り返した。
Yagita et al, PNAS, 2010
(註1) 分化誘導
分化誘導物質などの刺激により、幹細胞を異なる性質をもつ細胞に分化させること。
(註2) 未分化状態
将来分化してさまざまな性質をもつ細胞になる潜在能力がある状態。
3. 体内時計が形成される時期
次に、マウスの発生過程で実際に体内時計が出現する時期を調べました。さまざまな段階のマウス胚から取り出した細胞を培養して時計遺伝子のリズムを見たところ、器官形成が盛んに行われる10.5日から12.5日の胚(E10.5〜E12.5)には体内時計のリズムが見られない一方、母体内で成長が進んだ15.5日から17.5日の胚(E15.5〜E17.5)の細胞では明瞭な体内時計のリズムが確認できました。やはりマウス胎仔でも体内時計の形成はかなり遅いことがわかりました。
また、体内時計が形成されていないE10〜E12と、体内時計が形成された後のE17〜E19のマウス胎仔の心臓をそれぞれ4時間ごとに採取し、RNA-seq法(註3)によって網羅的に遺伝子発現レベルを調べました。通常の成体マウスでは、約5〜10%程度の遺伝子に体内時計の発現リズムが見られますが、E17〜E19のマウス胎仔では、これに近い約5%の遺伝子に明瞭な発現リズムが観察されました。ところが、E10〜E12のマウス胚では、リズムがある遺伝子はほとんど検出されなかったのです。母胎内にありながら発現リズムがある遺伝子がほとんど検出されないという結果は、全く意外でした。これは、母親のリズムが胚・胎仔には影響していないことを示しています。環境周期への同期(胎仔においては母体リズムへの同調)についても、母体のリズムに同調して受動的にリズムが生じるのではなく、実は胎仔側での体内時計の形成時期と並行して成立する現象である可能性が示されました。(図3)
私たちはES細胞やマウスの初期胚でなぜ体内時計がリズムを刻まないのか、そのしくみを詳細に調べました。その結果、ES細胞やマウス初期胚では、後の発生時期では体細胞の核に局在して体内時計としてはたらくPERタンパク質が、核ではなく細胞質に存在することがわかりました。さらに、体内時計の要である転写因子 CLOCKでは、mRNAの発現があるにも関わらずCLOCKタンパク質への翻訳が完全に抑制されていたのです。この転写後の翻訳抑制の機構は非常に厳密で、Clock mRNAを核内に凝集させることでCLOCKタンパク質が全く検出できないほどでした。遺伝子ごとに異なった制御機構で、いわば二重三重に体内時計のリズム発振を抑制していることがわかりました。(図3)
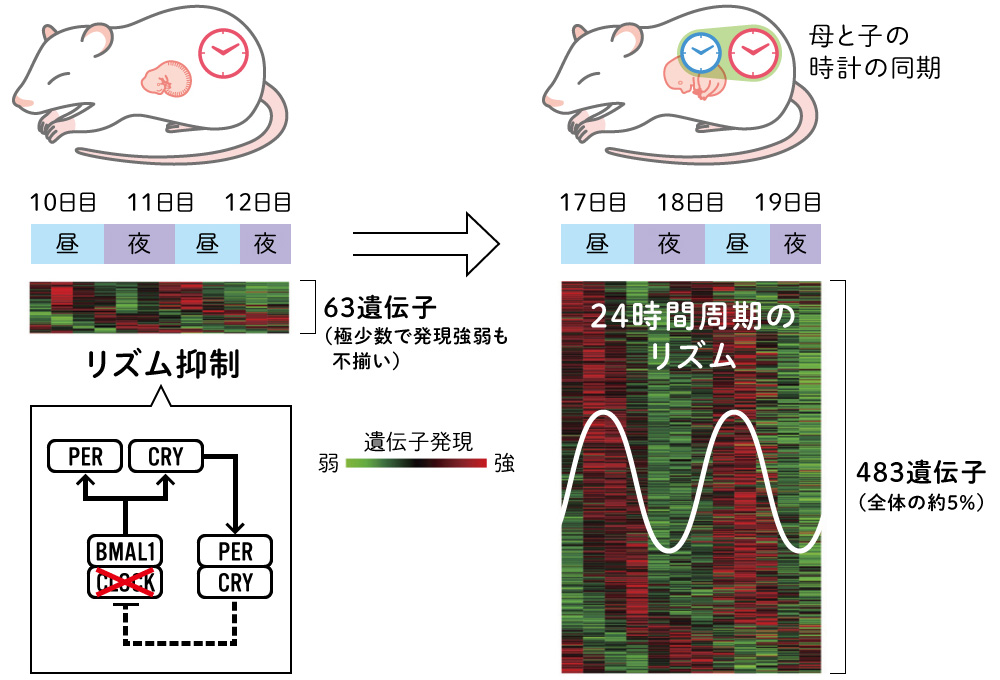
(図3) 体内時計の抑制と形成
マウス胎仔の48時間の間の経時的な遺伝子の発現リズムを調べた。
17~19日目では約5%の遺伝子に約24時間の周期的な発現が見られたが、10~12日目ではほとんど見られなかった。この時期は、体内時計の鍵因子CLOCKが強く抑制されており、体内時計がはたらいていない。
Umemura et al, PNAS, 2017
(註3) RNA-seq法
次世代DNAシーケンサーを用いて、特定の生物組織で発現している遺伝子群を網羅的・定量的に同定する方法。
4. 体内時計と分節時計の関わり
体内時計のリズムが見られないE12.5は、マウスの器官の元(原基)が全て作られる時期に当たります。このことから、マウスの個体発生では、器官原基の形成が終わるまでは体内時計が形成されない、という仮説が浮かび上がりました。
哺乳類の発生初期には、器官原基の一つである体節が形成されるというメインイベントがあります。体節形成は分節時計と呼ばれる別のもう一つの時計のリズムで制御されています。分節時計は、発生過程で形成される未分節中胚葉(PSM)という部位ではたらき、これが脊椎動物の繰り返し構造である脊椎のもと(体節)となります。哺乳類だと7つの頚椎・12個の胸椎・5つの腰椎と、キリンでもネズミでもヒトでも同じ数の脊椎を作ります。分節時計による体節形成も、非常に厳密に制御されたリズムによってできているのです。(図4)
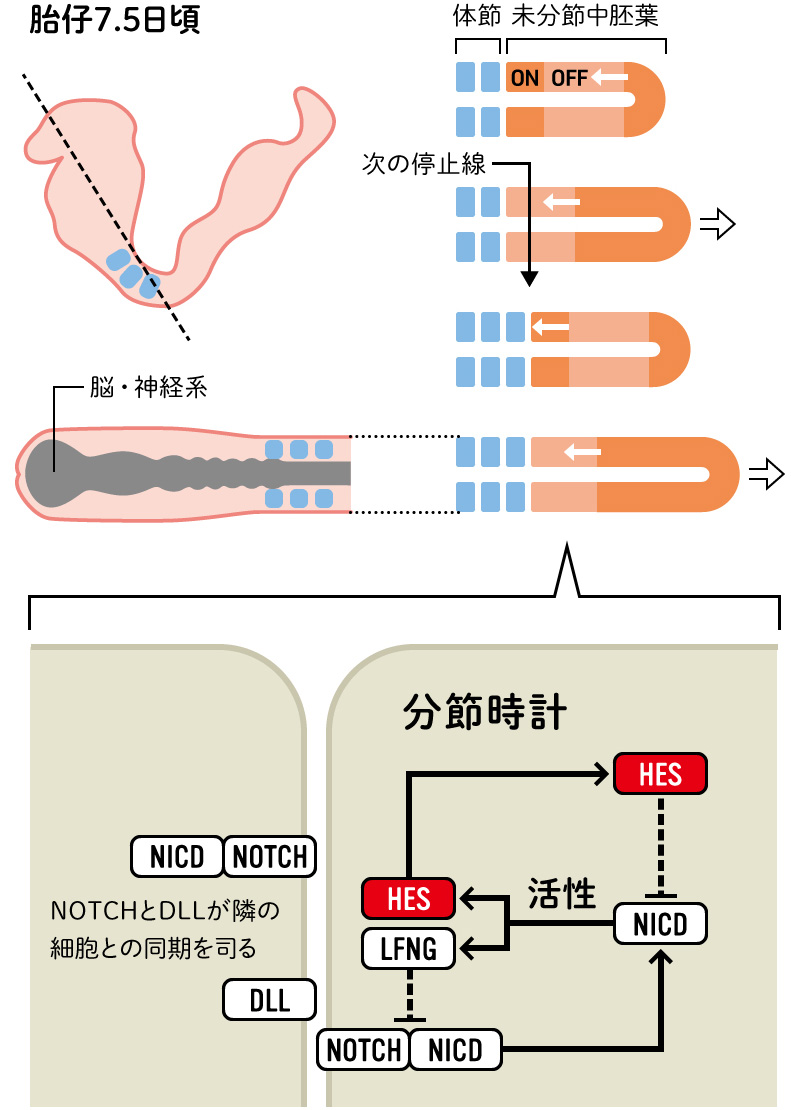
(図4) 体節形成にはたらく分節時計のしくみ
未分節中胚葉の後方から、シグナルの波が約2時間周期で繰り出され、波の停止線に行き着くと体節1対がくびり切れ、体節が次々と作られる。このシグナルは、主に分節時計の中心を担うHESタンパク質の増加(ON:NICDによる転写活性)と減少(OFF:HESによるNICDの転写抑制)によって生み出される。
分節時計の要となる遺伝子の一つはHes7で、これを欠失させるとPSMで分節リズムが生じず、体節が形成されません。マウスの体節形成期ではHes7の発現が約2時間周期でリズム発振することが欠かせません。興味深いことにHes7は、24時間周期の体内時計で重要なPer1という時計遺伝子と哺乳類のゲノム上で隣り合っているのです。Per1は哺乳類の体内時計でClockと共に最初に発見された時計遺伝子で、生体内で最も顕著な発現リズムが見られるものの一つです。異なる周波数のリズム発振を担うPer1とHes7のゲノム上での配置は、発生初期における体内時計の抑制との関連性を想起させます。しかも、一つの遺伝子発現が生じると、ゲノム上で隣接する遺伝子の発現に影響するリップル効果という現象が知られています。これらのことから、体内時計と分節時計の干渉が、発生初期における体内時計の抑制と関係するのではないかという仮説が生まれました。(図6)
私たちは、ドキシサイクリン(Dox)という抗生物質を加えると、体内時計の鍵となるCLOCK/BMAL1を発現するES細胞を樹立し、分節時計のリズムに及ぼす影響を調べました。ES細胞を未分節中胚葉(iPSM)に分化させ、CLOCK/BMAL1を発現誘導すると、それまで明瞭だった分節時計のHes7発現リズムが消えることがわかりました。これは、ES細胞やマウス発生初期胚では機能が強く抑制されているCLOCK/BMAL1がはたらくことで、分節時計に重篤な影響をきたす可能性を示しています。
次に、CLOCK/BMAL1の発現誘導が実際に体節形成に影響を及ぼすのか確かめました。iPSMの実験と同じマウスES細胞を用い、人工胚のガストロイド(註4)を分化誘導しました。ここで、Hes7の発現リズムに伴って体節様構造が形成されることを確認した後、Doxを加えてCLOCK/BMAL1を強制発現したところ、Hes7の発現リズムが消失するとともにPSMの分節も見られなくなりました。この結果は、CLOCK/BMAL1の発現によって、分節時計が干渉を受けたことを示しています。(図5)
(図5) リアルタイムイメージング (左:Hes7遺伝子の分節時計リズムの変化 右:体節様構造の変化)
人工胚を用いて、Hes7の発現リズムに伴い体節様構造が形成されることを確認した後、Clock/Bmal1の発現を誘導すると、Hes7の発現と体節様構造が消失。体内時計による分節時計の干渉をとらえた。
Umemura et al, PNAS, 2022
(註4) ガストロイド
幹細胞を用いて人工的に体が作られる過程を再現した胚組織。
実際に、CLOCK/BMAL1の発現誘導によって影響を受けた遺伝子を調べると、分節時計のリズム発振を制御する細胞内シグナル伝達経路である、MAPKシグナル経路(細胞表面からの信号を核内に伝える)・WNTシグナル経路(細胞の運命を決める)・Notchシグナル経路(隣の細胞との同期を司る)に関わる多くの遺伝子発現が変化しており、体内時計の鍵因子が分節時計のリズム制御に強く干渉することがわかりました。(図6)
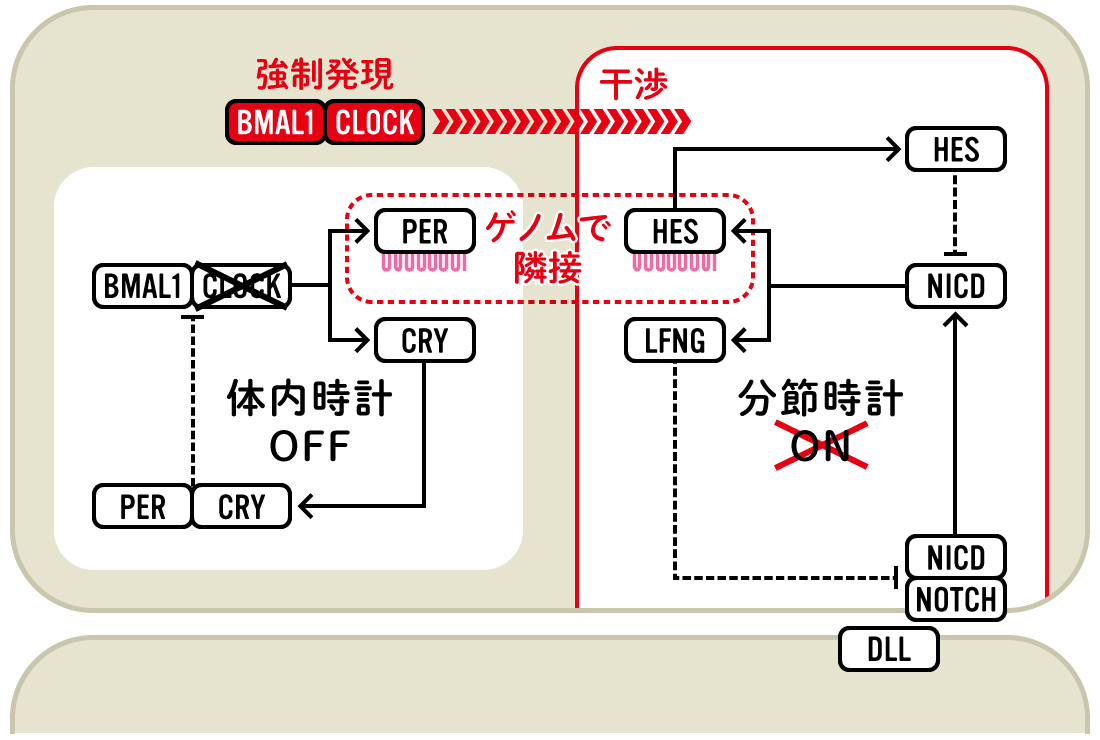
(図6) CLOCK/BMAL1による分節時計の阻害
強制的に発現誘導したCLOCK/BMAL1が、PER1とゲノム上で隣接するHES7など、分節時計に関わる遺伝子群の発現を変化させることで、周期的な発現秩序を乱すと考えられる。
Umemura et al, PNAS, 2022
5. 分節時計と体内時計のリズム切り替え現象
分節時計と体内時計の重要な機能は単なる遺伝子や分子の有無ではなく「リズムを生み出す」こと、またその「変化のしかた」に意味があります。実際、分節時計が機能しているPSMでは、分節時計を生み出すHes7などの時計遺伝子と同様に、数百におよぶ多くの遺伝子発現に2時間周期のリズムが見られることが報告されています。この時期には、2時間周期の時間秩序がその組織を支配していると考えてもよいかもしれません。同様に、生後は昼夜のリズムに同期する24時間周期のリズムが生体機能を制御していますが、細胞分裂でも代謝でも24時間周期の時間秩序が保たれて機能していることがわかっています。
ここで面白いのは、体節形成を司る分節時計の周期は、マウスでは2時間、ヒトでは5時間というように種によって大きく異なることです。これは分節時計の周期の長さそのものに普遍的な必然性がないことを示しています。一方で、哺乳類から昆虫、シアノバクテリアに至るまで、体内時計は24時間周期です。同じリズムであっても、分節時計と体内時計はその役割が異なります。分節時計は、正確に体節形成を制御するためのしくみであり、内的同期こそが全てです。一方体内時計は、一個体の中で内的同期させるだけでなく、地球の自転に伴う環境サイクルに体の機能を適応させる外的同期を担うしくみなのです。このことから、発生過程は、内的同期のみに特化した体節形成期(形態形成期)と、環境サイクルに生体機能を適応させる機能形成期という2つの「時間」に分けられるのではないでしょうか。分節時計と体内時計のリズム切り替えは、発生過程における大きな役割分担の切り替えを反映するものかもしれません。(図7)
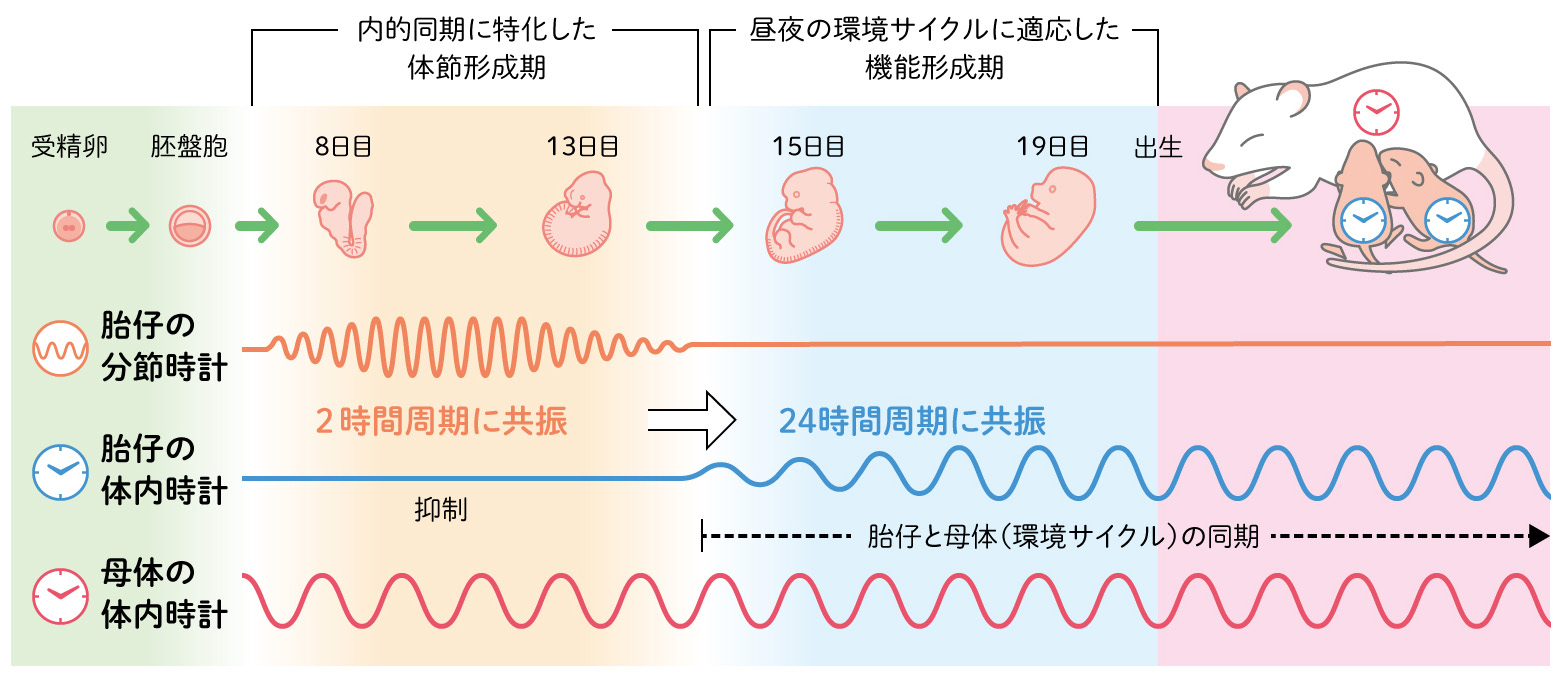
(図7) 発生過程に現れる2つの時間
体節形成期の分節時計がリズム発振している組織では、多くの遺伝子発現に約2時間周期が見られ、機能形成期では、多くの遺伝子発現に母体のリズムに同調した約24時間周期が見られる。
Matsuda et al, Nature, 2020
Umemura et al, PNAS, 2022
幸運に恵まれた 忘れられない実験
ES細胞の分化誘導培養については、幹細胞生物学や再生医療の分野で非常に精力的に技術開発が行われ、特に2006年のiPS細胞の発明以降、爆発的な進歩を遂げてきました。多能生幹細胞を用いた再生医療は、ES細胞やiPS細胞を分化誘導し正常な神経細胞や心筋など必要な細胞を作って、それを移植することで機能回復を目指すものです。
このES細胞の分化誘導系を用いた実験は、「体内時計とは環境のリズムによって誘導されるのか?それとも、細胞にプログラムされたしくみによって自律的に形成されるのか?」という問いに明確な答えを出すことができます。結果は本文で示したように、体内時計は外界の環境サイクルに依存せず細胞自律的に形成されることが証明されました。こういうと簡単ですが、実際には私の実験は最初は全くうまくいかず途中で諦めかけたほどでした。私は幹細胞生物学者ではなく、生体リズムを専門とする環境生理学者です。ES細胞の培養技術は幹細胞の専門家の先生に弟子入りし、みっちり教えていただきながら実験を進めていました。幹細胞生物学の分野では、ES細胞の分化誘導培養期間は通常1週間程です。1週間分化誘導しても時計遺伝子の発光レポーターに全くリズムらしき変化が見られなかった時は、幹細胞生物学の先生から「あかんのちゃう?」と諦めの言葉も出ていました。
この発光レポーターを連続モニターする装置は、シアノバクテリアの体内時計研究で著名な名古屋大学の近藤孝男先生が開発されたものを哺乳類細胞に応用したもので、一度に288サンプルを計測できる装置でした。多くのサンプルを同時に試すことができ、これが大きな幸運を呼び寄せました。当時、これほどのサンプル数を同時に計測できる装置は世界になく、少ないサンプルを厳選して観察するような状況でした。しかし、私にはこの装置がありましたので、非常に多くのサンプルを準備していました。ある日、計測し忘れて2週間分化誘導し続けていたプレートに気づき、ケチることなく発光リズムを測定した時のことです。なんと、このオマケで測定した2週間分化誘導培養したプレートのサンプルだけが、非常に美しい約24時間周期の発光リズムを示したのです。この時の驚きと喜びは、今でも忘れられません。
幹細胞生物学の常識から外れたこの現象は、その後、遅すぎる哺乳類体内時計の発生のなぞとして、本記事の分節時計と体内時計のリズム切り替え現象発見につながったのです。

八木田和弘
(やぎたかずひろ)
1995年京都府立医科大学卒業。内科での研修後、京都府立医科大学大学院医学研究科博士課程修了。神戸大学医学部助手、名古屋大学理学部助教授、大阪大学医学系研究科准教授を経て、2010年より現職。
写真は、『海の京都』を代表する天橋立をバックに。京都府立医科大学北部医療センターが近くにあり、地域医療と健康医学の拠点形成のため、よく訪れます。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)

.jpg)
.jpg)