RESEARCH
細胞に見る
老化のライフサイクル
老化細胞は、分裂を停止した細胞であるが、老化前の細胞とは異なるさまざまな特徴を見せる。組織の恒常性維持に寄与する一方で、除去を逃れた老化細胞はがんの亢進や個体の老化に影響する。我々は、老化による細胞の変化を「機能の衰え」ではなく、「機能の獲得」と捉え、遺伝子発現の状態を変えるエピゲノムに注目している。
1.老化細胞とは何か
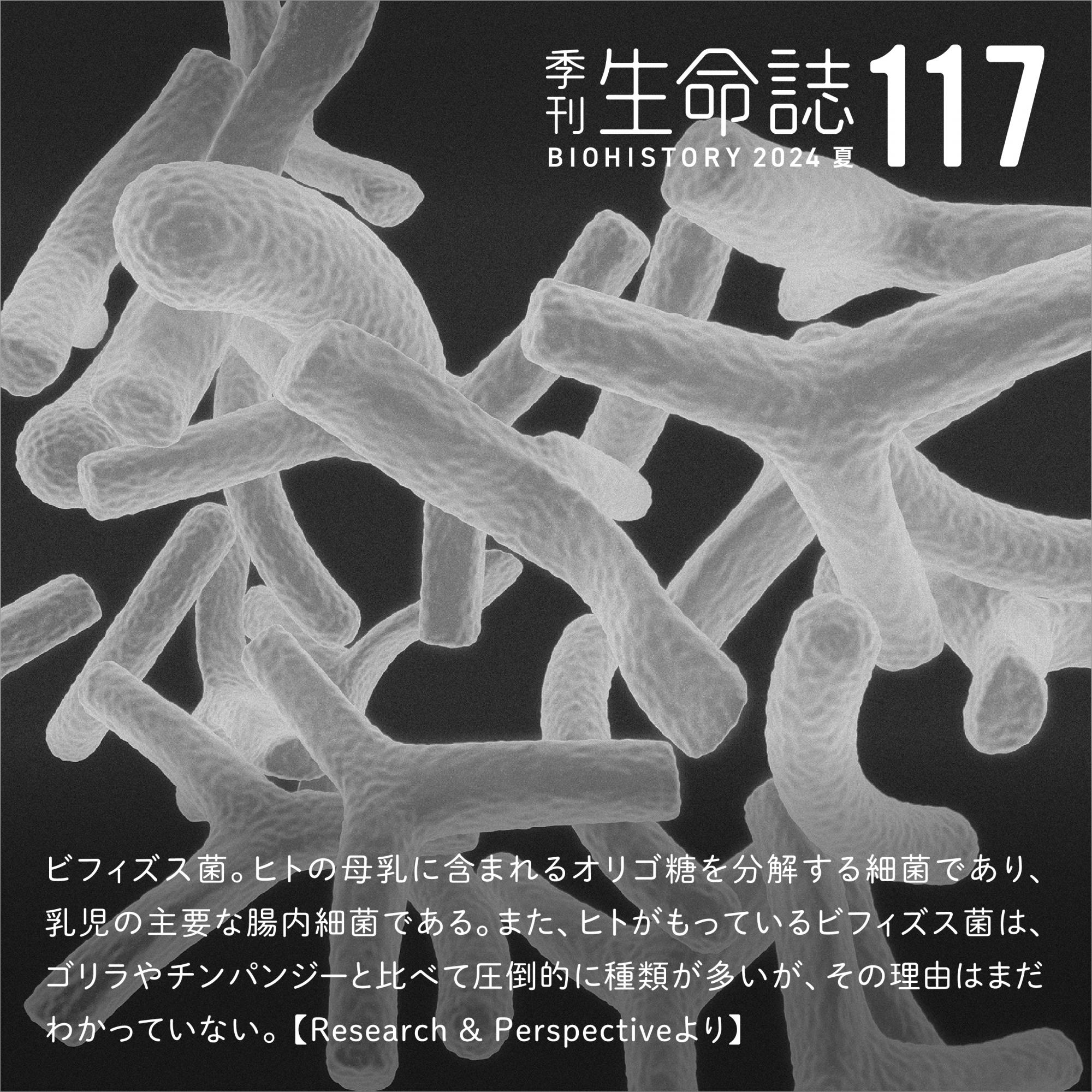
老化とは、加齢による身体の機能の衰えをいうが、細胞にも「老化」がある。正常なヒト体細胞由来の培養細胞は、一定の回数分裂をすると増殖を停止する。分裂回数を時間の経過として、個体の老化になぞらえ、分裂を停止した細胞を「老化細胞」と呼ぶ。この原因として、染色体の末端にあるテロメア配列が分裂のたびに短縮することでDNAが損傷し、細胞周期が非可逆的に止まることがあげられる。一方で、細胞に対して、酸化ストレスや放射線や薬剤等のDNA損傷を誘発する様々な刺激を加えると、細胞周期が停止するが、これも老化細胞の一種と考えられる(図1)。DNA損傷は細胞周期を停止するシグナルであり、細胞老化は、異常な細胞を増やさないための生理的な反応と考えられる。
実験では、正常な細胞にある種のがん遺伝子を誘導すると細胞老化がおこる。例えば、がん遺伝子のRASをヒトの正常線維芽細胞に入れて過剰発現させると、一時的に増殖能が増し、前がん状態になる。その後、がん抑制遺伝子の働きにより増殖が止まり、老化細胞となる。そこで細胞老化はがん細胞の増殖を止めるがんの防止の役目をもつとされている。
(図1) 細胞の老化
細胞が分裂を重ねることによる老化のほかに、紫外線や酸化ストレスなどのストレスによっても老化が誘導される。がん誘導老化は、がん遺伝子RASなどの活性化を誘導することで見られる。老化誘導による細胞周期の停止は、細胞周期に分裂のチェックポイントを通過できないためと考えられる。
2.老化細胞の機能
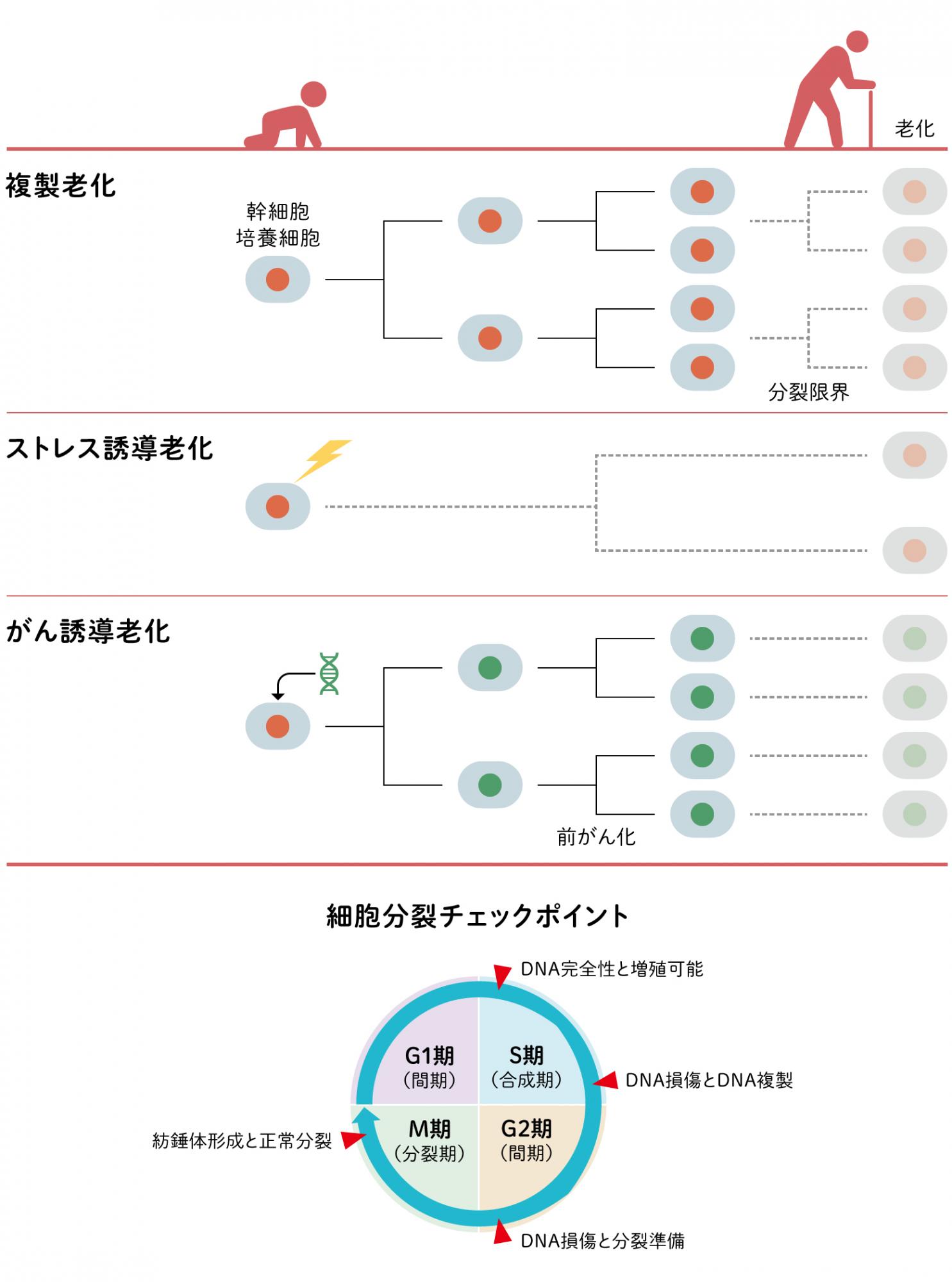
老化細胞は、細胞分裂は停止しているが、細胞の活動は止まっていない。むしろ、老化する前の細胞がもたない様々な性質をもつように変化することがわかってきた。細胞の老化による変化に、細胞の外に様々な分子を放出する分泌細胞への変化があり、これを細胞老化随伴分泌現象(SASP)と呼ぶ。SASPを獲得した細胞は、サイトカインなどの炎症や細胞増殖に関わる因子や、それを介在する細胞間マトリックスの修飾酵素などを分泌する。例えば、老化したヒト線維芽細胞は、SASPによりインターロイキン1を分泌するが、これはマクロファージなどの免疫細胞の特徴であり、老化のため変化することで異なる機能を獲得したとみられる。このように細胞の老化は、細胞の種類や老化の刺激、時間経過によって様々な変化をみせる複雑な生理反応であることがわかってきた。
(図2) 細胞老化による変化
老化細胞は、分泌表現型(細胞老化随伴分泌現象:SASP)に変化すると分泌因子の種類によって周囲の組織に影響を与える。写真は、ヒト線維芽細胞(IMR90)の老化による変化。老化マーカーである。老化細胞は、ベータガラクトシダーゼ活性により青くそまり、一般に細胞が大きくなる。
3.老化細胞の相互作用
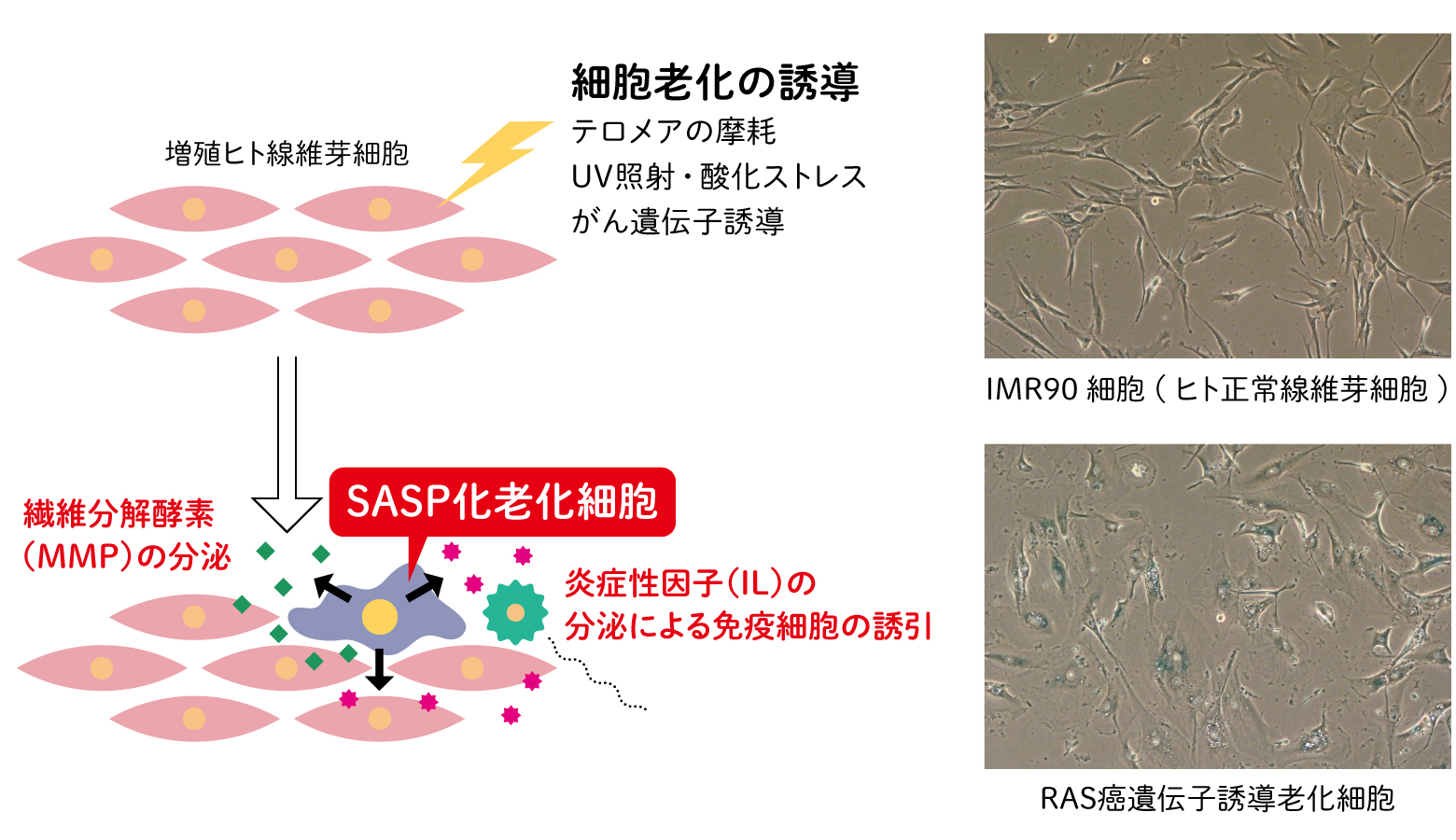
老化細胞は体内では、どのように振る舞うのだろうか。個々の細胞は組織や臓器の構成要素として周辺の細胞と相互作用することで、身体の機能を担っている。SASPに変化した老化細胞は、細胞外にシグナルを出すことで、細胞間のコミュニケーションに様々な影響と与えると考えられる。皮膚や肝臓などの損傷箇所では、最初は細胞が増殖して組織を補い、コラーゲンなどの繊維タンパク質をつくり傷はふさがる。その後、細胞が老化して増殖を停止し、SASPにより余剰な繊維タンパク質を分解する酵素が放出されるため、瘢痕が解消される。最終的にはSASPの分泌シグナルで誘引された免疫細胞により老化細胞が除去され治癒に至る。
また、がん化した細胞は無秩序に増殖するが、老化が進み分裂が停止するとがんは抑制される。しかし、老化細胞がSASPに変化すると周辺の細胞に影響を与えるため状況は単純ではない。がん細胞に細胞老化を誘導した場合、サイトカインなどの炎症性因子が分泌されると、免疫細胞が誘導され、がん老化細胞が除去されることでがんは収束する。その一方で、サイトカインは細胞増殖因子でもあり、自身を含む周辺の細胞の増殖を促してがんが再発する可能性がある。我々の研究では、分泌因子を介した情報の受け渡しだけでなく、隣り合う細胞に直接シグナルを伝え、老化細胞に転換することも確認している。細胞の老化は、体内で組織の維持や再生を担うが、がんの進行や老化細胞が除去されないことによる悪影響もある。より大きな視点から見ると、細胞が、自ら老化することで機能を変化するとともに、相互作用により組織レベルでの変化にも関わる生体において普遍的な現象とも考えられる。
(図3) 組織内での老化細胞の機能
細胞老化は、培養細胞で研究されていたが、正常な組織での老化細胞の機能がわかってきた。老化細胞は組織の恒常性を保ち、最終的に除去されることで健康な細胞のライフサイクル を示す一方で、がん化や老化の促進にも関わる。
4.老化とヘテロクロマチン
老化により細胞が機能を変えるのはなぜだろう。多様な性質の出現からは個別の遺伝子のはたらきというより、ゲノム全体にかかわるエピジェネティックという視点がうかぶ。エピゲノムの調節には、クロマチンの変化が関わる。老化細胞では全体的にヘテロクロマチンが失われると言われていたが、ゲノム技術の進歩により、その変化が単純に一方的ではないことがわかってきた。ヘテロクロマチンは、ゲノムDNAが凝縮した状態で、遺伝子の転写がおさえられている(サイレンシング)。構造的ヘテロクロマチンでは、染色体の中心のセントロメア、両端のテロメアなどの繰り返し配列が細胞の種類にかかわらずサイレンシングされている。一方、条件的ヘテロクロマチンは、細胞の分化や刺激等に応じて活性型のクロマチン(ユークロマチン)に変化し、細胞の特徴を決める遺伝子が含まれる。
我々は、ヒトの線維芽細胞にがん遺伝子RASを導入して、老化を誘導した正常の細胞で、クロマチンの凝集を伴う新たなヘテロクロマチン形成を見出した(細胞老化特異的ヘテロクロマチン構造:SHAF)。この際、核膜周辺につなぎ止められているヘテロクロマチンが、核の内側に放出される。SAHFの生成には、ヘテロクロマチンを核の周辺につなぎとめるタンパク質ラミンB1の減少と、その放出されたクロマチンを凝集させる構造タンパク質HMGA1が関わっている。その構造を見ると、中心に構造的クロマチン、条件的クロマチンがそれを囲み、さらに外側にユークロマチンといった同心円の層構造をもっていた。そこで、クロマチンを構造で分けることで、遺伝子発現を安定にし、老化細胞特有の性質に関わるのではないかと考えた。
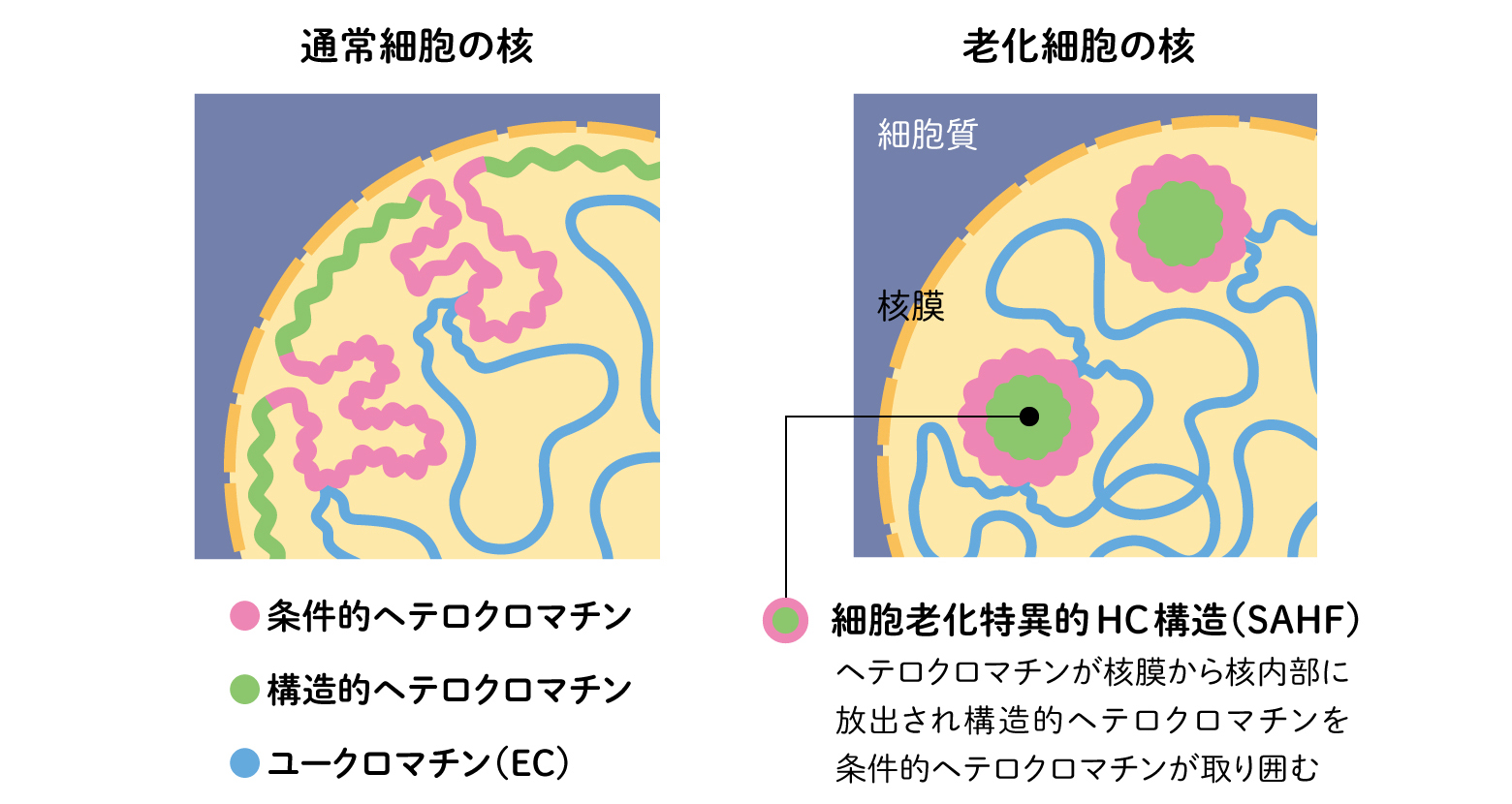
(図4) 老化とヘテロクロマチンの変化
老化細胞の特徴としてヘテロクロマチンの減少が知られていたが、不活性なヘテロクロマチンが同心円状の特徴的な構造(細胞老化特異的ヘテロクロマチン構造:SAHF)となり核内部に局在する構造変化もおこる。
5.老化とゲノム変化
SAHFは実際に、遺伝子発現の変化に関わるのだろうか。老化した線維芽細胞に発現する遺伝子を調べると、皮膚の細胞の角質化に関わる遺伝子が発現していた。これは、表皮に存在する細胞(ケラチノサイト)で、細胞が終末分化し皮膚が角質化する過程で発現が増える遺伝子で、通常の線維芽細胞ではたらくことはない。そのためこれらの遺伝子は線維芽細胞では、核膜周辺の構造的ヘテロクロマチン領域にある。一方で、未分化のケラチノサイトでは、サイレンシングされ条件的ヘテロクロマチンにあるが、成熟する(角化する)とユークロマチンになる。核の中心部の転写が盛んな場所にあり、表皮細胞の系譜特有の変化をたどる。そこで、老化した線維芽細胞の角質化遺伝子を見ると、核膜から離れたSAHFの周辺にあり、凝集が弱まり転写が可能な状態に変化していた(図5/写真)。構造的クロマチンの性質をもちながら、SAHFからはみ出すことで転写因子が接触できるようだ。これは、ヘテロクロマチンの変化をとおして、本来の細胞の系譜から外れた遺伝子が発現できることを示している。また、系譜に沿った遺伝子発現とは、異なる過程を経ている点も興味深い。ここから、クロマチンという大きな構造から遺伝子の転写に至る階層的なエピジェネティックランドスケープの変化が、老化特有の新たな機能獲得の一因ではないかと考えている。
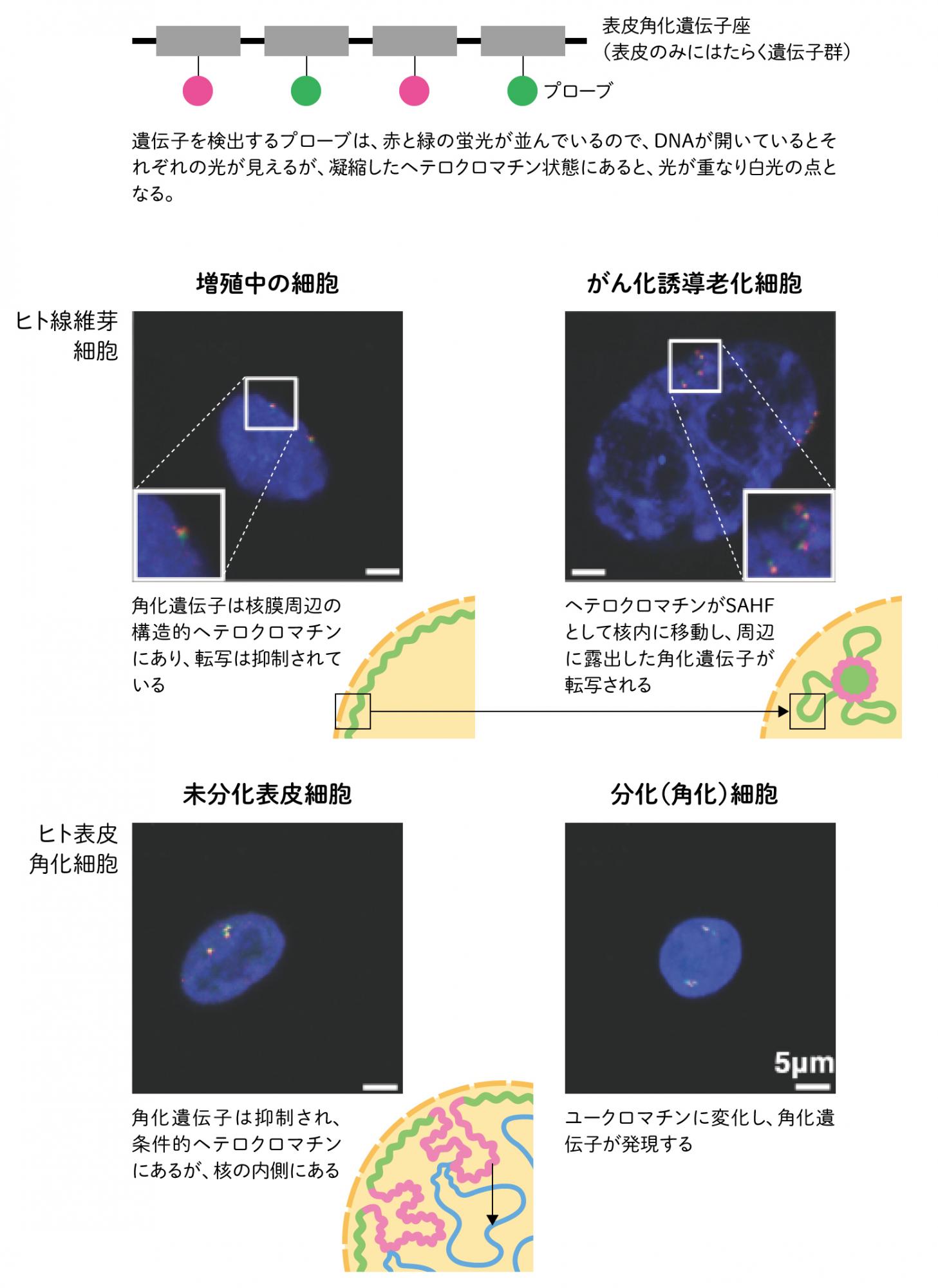
(図5) 老化による遺伝子発現の変化
老化細胞では、SAHFの周辺には、転写活性が高い領域があり、老化する前の細胞系統でははたらかない遺伝子が発現する。通常の細胞が、細胞系譜に従って遺伝子のはたらきを変える方法(ヘテロクロマチンからユークロマチンへ)と異なる。
6.細胞老化のライフサイクル
個体の発生や維持において、組織では前駆細胞が増殖し、終末分化し分裂を停止した細胞が特有の機能をもつ。細胞老化では、増殖停止した細胞が老化細胞として特有の機能をもつ。SASPにより外にはたらきかけ、周辺の細胞の環境や免疫細胞の活性化を促し、最終的には除去される。細胞の分化と老化は共に細胞停止に伴う機能の獲得であり、細胞老化は細胞の「ライフサイクル」の一つといえる。正常の細胞老化は、組織の恒常性維持を担い、若い個体でも日常的におきている。老化した個体においては、このバランスが乱れ、過剰な炎症反応、老化細胞の蓄積により臓器などの機能の低下につながる。つまり、正しい老化細胞の「ライフサイクル」を維持できなくなることが、個体老化の正体と考えられる。マウスの実験で、老化細胞を除くことが老化防止になることがわかり、老化細胞の除去(セノリティックス)や機能阻害(セノモーフィックス)に期待が集まっている。また、がんの治療においては、がんの細胞集団の細胞は不均一であり、抗癌剤や放射線などの治療の影響で多様な老化細胞に変化しうることが、治療を難しくしている。老化細胞に注目することでがんの微小環境の理解が進みつつある。
細胞の老化は細胞死のように死に向かう一方ではなく、多様な変化を伴う複雑な現象であり、新たな機能を獲得するという、「老化」の言葉のもつイメージとは異なる面ももっている。クロマチンの大胆な再配置を含む、細胞のインフラであるエピゲノムの改変が、不可逆的な機能変化である「老化」の本質ではないかと考え、研究を進めている。
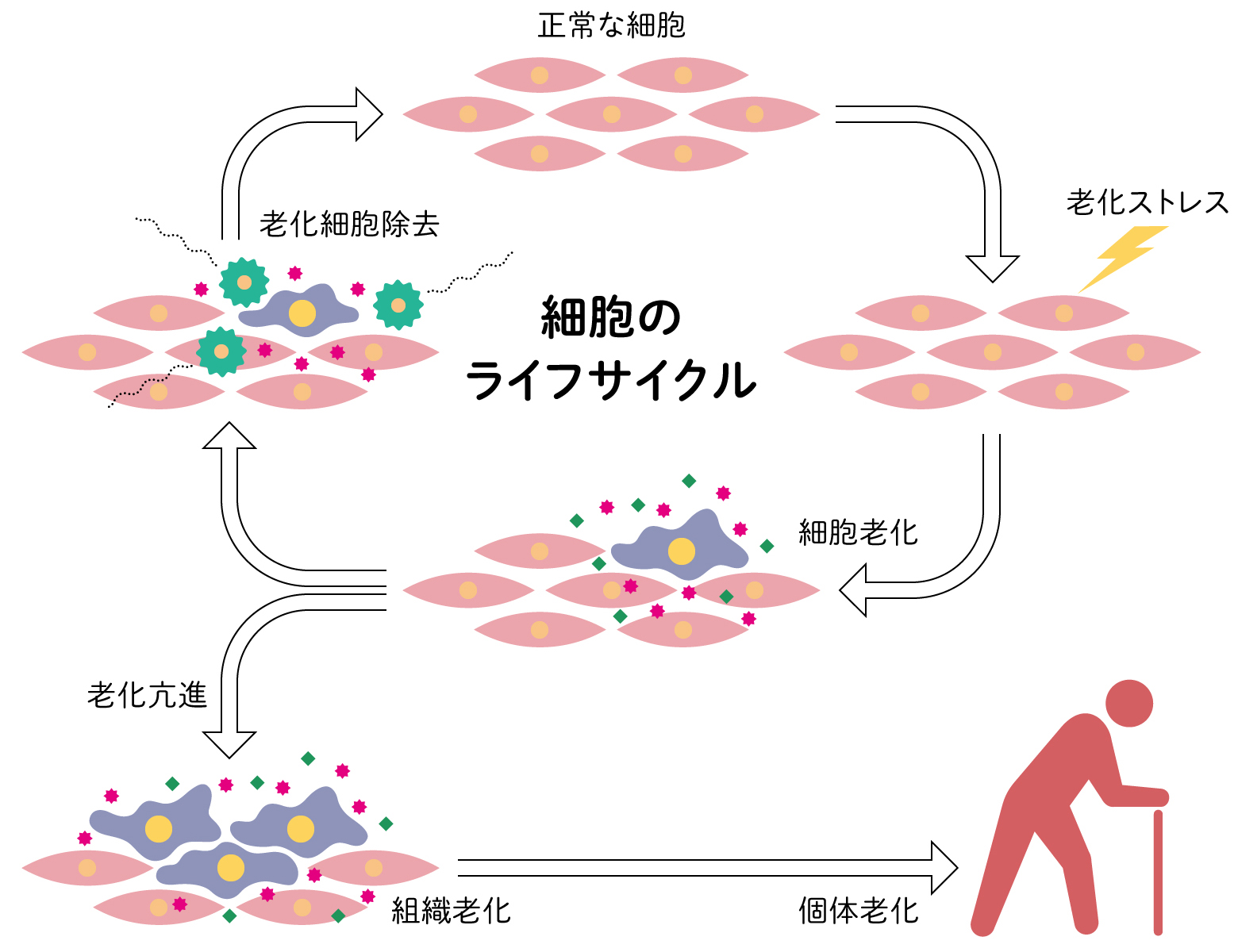
(図6) 細胞と老化のライフサイクル
老化細胞は、細胞のライフサイクル の一部として独自の機能をもつが、サイクルを外れることで組織や個体を老化に導く。

成田匡志(なりたまさし)
英国がん研究所、ケンブリッジ大学、グループリーダー、教授。1992年大阪大学医学部卒業、臨床勤務(外科)。大阪大学大学院医学系研究科博士課程を経て、2000年よりコールドスプリングハーバー研究所、ポスドク。2006年より英国がん研究所、ケンブリッジ大学、グループリーダー。2019年よりケンブリッジ大学、医学部教授。
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)
.jpg)
.jpg)