VOL.4 胚のいつ、どこで、何を発生させるのかには欠かせない抑制機構
近藤寿人(JT生命誌研究館 顧問・表現ディレクター)
それまでその気配もなかった状況のもとで、あることが始まると、それを無から始めるための特別の働きがあったーーと私たちは考えがちです。しかし、生き物の調節には、「無から有」のように見える現象が既に準備されていて、その準備されていたものの蓋を開けている(脱抑制)に過ぎない場合が少なくありません。
一例をあげれば、ラクトースオペロンの研究で有名なジャック・モノー(Jacques Monod)は、1950年代、乳糖分解に関わる大腸菌のβ-ガラクトシダーゼの遺伝子の発現の機構を、『誘導物質がある発現機構を新たに組み上げて作動させる』という仮定のもとで研究していましたが、そのような機構は見つかりませんでした。その年月ののちに発想を変えて、レプレッサー(抑制タンパク質)の作用を誘導物質が解除するという「脱抑制」機構を仮定することによって、問題を解き明かしたのでした[文献1]。
このような脱抑制によって、ある組織の発生が始まる代表例として、神経系の発生があげられます。Spemannが提唱したオーガナイザーについては、「発生生物学の静かな革命 VOL1」でも触れましたが、その後の神経系発生を誘導する物質の研究が陥った混迷の時代と、異なったアプローチからの問題の解決について、まずお話しします。VOL1の「オーガナイザーの不確実さ」の項目の続きになります。
発生過程全体を眺めると、発生を積極的に進める機構(活性化機構)だけで、ある組織の発生を正確に制御できることはまずありません。発生の制御には常に、抑制機構が関与しています。型染めをイメージしてください。活性化機構は、いわば染料を含んだ刷毛です。抑制機構は型紙です。型紙の抜けたところに図柄が浮かび上がります。発生の調節にはそれと似たところがあります。
後半では、「発生生物学の静かな革命 VOL2」でも触れたヘッジホッグシグナルの働きの例をお話しします。活性化機構と抑制機構の絶妙なバランスの例です。それを発展させて「抑制機構」の一端を担う「マイクロRNA(mi RNA)」についても紹介しましょう。
A. 神経系の発生開始は、BMPシグナルからの脱抑制による:神経誘導物質を求めた古典期の混迷
VOL1でも触れた、「オーガナイザー説」をもたらしたシュペーマン・マンゴルド(Spemann-Mangold)の実験(1924)[文献2]は、『イモリの原腸胚の原口背唇部を、他のイモリの胚(宿主)の反対側の位置に移植すると、その場所に、神経系を中心とした2次的な(2つ目の)胚構造ができ、その胚構造の多くの部分は宿主由来の組織であった』というものです。しかし、組織移植の成功率は1%程度、しかも上記の『 』の内容を示せる尾芽胚にまで発生したのは論文に記載された6例の中の1例に過ぎませんでした[文献2](図1右上)。 この低い成功率は、当時浸透圧の問題を考慮せずに、水の中で手術を行なったために、多くの手術胚が死んでしまったことによります。この問題を解決したのが、ヨハネス・ホルトフレーター(Johannes Holtfreter)で、彼が工夫した両生類用の生理的食塩水(Holtfreter液として現在でも愛用されています)によって、移植胚の生存率が格段に向上しました[文献3]。それでも原口背唇部を別の胚の表面に移植するのは難しく、若くして亡くなったHilde Mangoldにしかできないような技術だったのですが、移植ではなく、切り出した原口背唇部を胚の胞胚腔に差し込む(投函する)というEinsteck法が用いられるようになって(図1)、数年を経て初めて、Spemann-Mangold (1924)で報告された現象が他の研究室でも確認できるようになったのです[文献3]。
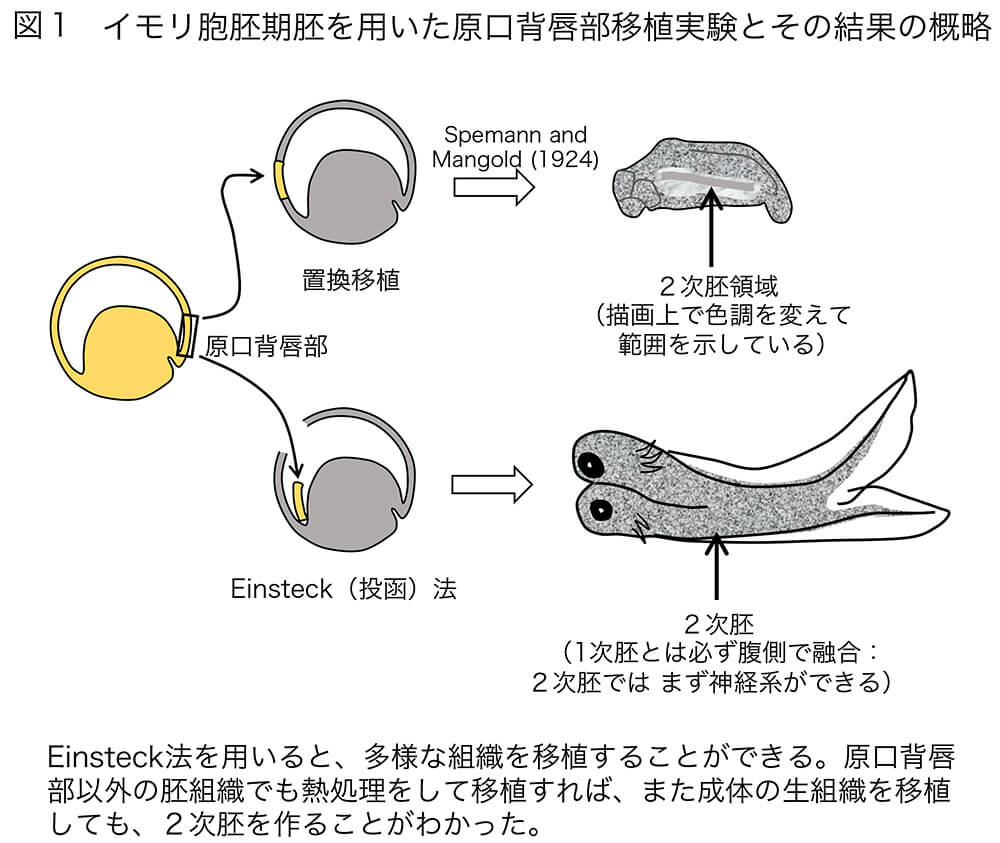
(図1)イモリ胞胚期胚を用いた原口背唇部移植実験とその結果の概略。1920年代から1930年代にかけて、Spemannのグループを中心として実施された。Holtfreterによる生理的食塩水の開発、またEinsteck法の工夫によって様々な実験が可能になった。神経系の発生が2次胚形成の中核プロセスであることを反映して、2次胚は常に腹側で1次胚と融合する。
熱処理をした組織を用いると、原口背唇部にとどまらずさまざまな組織が、また成体の生組織を用いると、肝臓や腎臓でも2次胚の発生をもたらすことが明らかになった。
1930年代になると、2次胚組織を生み出す物質(オーガナイザー因子)の探索の研究が、世界中の研究者を巻き込んで繰り広げられました[文献4]。2次胚の組織の中心には必ず神経組織ができていましたから、それをもたらす「神経誘導物質」の同定が課題の一つでした。その時代は20年間に及びます。Spemannは特に、物質ではなく生きた組織が神経誘導には必要だと考えていたので、それを証明するためでしょう、Holtfreterたちに、熱処理(100 ℃)、凍結処理をして「殺した」原口背唇部を移植して試すように指示しました。予想に反して、「殺した」原口背唇部を胞胚腔に移植すると、頭部を中心とした(殺さない組織を使った場合よりも)立派な2次胚組織ができることがわかりました。さらに、熱処理さえすれば原腸胚のどこを移植しても2次胚組織ができること、熱処理をしない成体の組織(肝臓や腎臓など)の小片を、両生類からあるいは哺乳類から取り出して移植すると、やはり神経系を持った2次胚組織ができることもわかって、混迷の時代を迎えました。誘導物質を同定しようとする実験からは、抽出に使った溶媒(弱酸、水=低浸透圧、アルコール)などで組織を短時間傷めるだけで、2次頭部組織の形成を引き起こすことも報告され、混迷のままその時代は終わりました。何が問題だったのでしょうか?それは、オーガナイザーが「強力な作用物質の働きで、発生するはずのない組織をーーいわば無から有を生み出すような機構で作り出している」という暗黙の仮定が、方向違いだったからだと思われます。
さて時は流れて、遺伝子クローニングの時代も円熟した1990年代に、Eddy M. De Robertisの研究室にいた笹井芳樹氏はアフリカツメガエル胚の原口背唇部で特徴的に発現される遺伝子を探して、その一つに目をつけ、コーディン(chordin)と名づけました。コーディン遺伝子のメッセンジャーRNA(mRNA)を人工合成して、将来神経系の発生には関与しないはずのツメガエル胚の割球に注入しました。その割球で、コーディン タンパク質が作られるはずです。すると、その胚には立派な2次胚組織が作られました。どの割球にコーディンmRNAを注入するかによって、頭部が作られたり、胴部が作られたりしました[文献5]。さらに、コーディン遺伝子から作られるコーディンタンパク質は、分泌されているBMPと呼ばれる一群のタンパク質を結合(ブロック)して、BMPタンパク質の働きを強力に抑制することを明らかにしました[文献6]。
その後の研究を簡単にまとめると次のようになります。両生類胚の胞胚期の外胚葉組織(エピブラストに相当: VOL1をご参照ください)は、その場所にかかわらず神経系を作る能力がある。しかしその神経系発生の能力は、BMPの作用によって抑えられている。コーディンの作用は、胚発生の適切なタイミングで、胚の場所を限定して、そのBMPからの抑制を解除して、潜在的であった神経系の発生を実施させることにある。
1930年から20年間の「神経誘導物質」の探索の研究には、「脱抑制」といった考え方が希薄であったために、観察された現象を正しく理解できなかったのだと思われます。細胞にストレスをかけたり、BMPの作用を抑制する物質を持つ組織を移植したりといった、さまざまの条件が契機となって、容易に外胚葉組織に神経系発生への「脱抑制」を引き起こしたのでしょう。
しかし、これでは話は終わりません。マウス胚(哺乳類)や、ニワトリ胚(鳥類)――あわせて羊膜類胚――の中でBMPの作用を抑制しても、神経系の発生を促すことはできませんでした。羊膜類のエピブラストにも、神経系を作る能力が潜在的に存在していますが、それを抑制しているのは、ノーダル(Nodal)という、BMPと似てはいるが異なった分泌タンパク質だったのです[文献7]。神経系発生に対する抑制因子は異なっていたとしても、神経系を胚発生のいつ・どこに作るかは、『脱抑制』によって決められるというのは、生物種を超えて普遍的な機構なのです。
胚発生の調節の中で、「抑制」効果を出す機構は多様です。遺伝子発現という観点から見ると、次のように整理できるでしょう。(1) シグナル因子の作用――上に述べたBMPやNodalシグナルの効果の一つは、SOX2などの転写因子の遺伝子の発現を抑えることです。(2) エピジェネティック制御(ATGCからなるDNAの塩基配列に直接的には依存しない制御)――DNAとヒストン等の複合体であるクロマチンの状態を調節して、転写因子のDNAへの結合を促進したり阻害したりするなど。(3) DNA上のある遺伝子の制御領域に結合した転写因子の作用――転写活性化因子が結合すると、その遺伝子の発現(転写)が促進され、転写抑制因子が結合すると、その遺伝子の発現が抑制される。(4) マイクロ RNAによる、転写後調節――遺伝子が転写されてできるmRNAに相補的な配列を持つマイクロ RNAが結合すると、そのmRNAは分解され、その結果としてその遺伝子由来のタンパク質ができなくなるといった調節。
以下では、遺伝子の活性化と抑制という2つの作用をあわせ持ち、ヘッジホッグシグナルの強度によってその作用を変化させる、Gli1, Gli2, Gli3という一群の転写因子の働きを見ましょう。胚の細胞が巧妙に抑制機構を働かせて、私たちの発生を実現している様を見ることができます。
B. 指の数は、ソニックヘッジホッグシグナルによる活性化機構と抑制機構のせめぎ合いによってきまる
1980年にChristiane Nüsslein-Volhard(ニュスライン-フォルハルト)と、Eric Wieschaus (ヴィーシャウス)は、現代の発生生物学に最も大きな影響を与えた画期的な研究を発表しました[文献8]。Mutations affecting segment number and polarity in Drosophila(ショウジョウバエの分節の数と極性を変化させる突然変異群)という論文です。まず、(1)ショウジョウバエが持つ全ての遺伝子のどれについても、ある個体集団の中に必ずその変異体が出現するような条件で突然変異を誘起しておき、(2)出現する変異体(多くは、幼虫の段階で致死)を網羅的に解析しましたーーこの網羅性がまず画期的だったのです。(3)その中で胚発生の制御に関する変異体の多くが分節に異常を示すことに気づき、それを分類して発表しました。ショウジョウバエの幼虫の腹側には、各々の分節の前の部分に小歯状突起(denticles)があって、それによって幼虫は匍匐前進するのですが、分節に関する変異体の多くは、その突起の配置が変化していました。その一つは、各分節の後半にも小歯状突起を持っていて針が一面に生えているように見えることからHedgehog(ヘッジホッグ;ハリネズミ)変異体と名付けられました(分節の後半が前半と同じ性質を持ちつつ前後の極性が逆転)。このヘッジホッグ変異体の原因遺伝子=ヘッジホッグ遺伝子を単離し、それがコードするタンパク質のアミノ酸配列を調べると、その配列の特徴から、ヘッジホッグ タンパク質は分泌タンパク質であることが分かりました。
ヘッジホッグ遺伝子は、脊椎動物にもあるのでしょうかーーそれに対応する遺伝子は3個見つかり、以下にお話しする、一番主要な脊椎動物のヘッジホッグ遺伝子をソニックヘッジホッグ (Shh; SEGA社のゲームキャラクターのSonic the hedgehogをもじった)と呼ぶことになり、あとの2つには実在のハリネズミDesert hedgehog (Dhh), Indian hedgehog (Ihh)が当てられました。
[1990年あたりまでに、発生過程の制御因子の遺伝子――シグナル伝達、転写制御、エピジェネティック制御、性の制御などに関わるものーーの多くは、ショウジョウバエと脊椎動物との間で共通していることが明らかになりました。そうなると、ショウジョウバエで発見された変異体から、動物界に共通の制御遺伝子が一挙に解明されることになりました。現在までに明らかにされた発生過程やガンの制御に関わる遺伝子の多くがショウジョウバエの変異体の名前を持っています。この基礎を与えたNüsslein-VolhardとWieschausには、同じくショウジョウバエの研究でHox遺伝子群を予言したEd. Lewisとともに、1995年のノーベル医学・生理学賞を与えられました。]
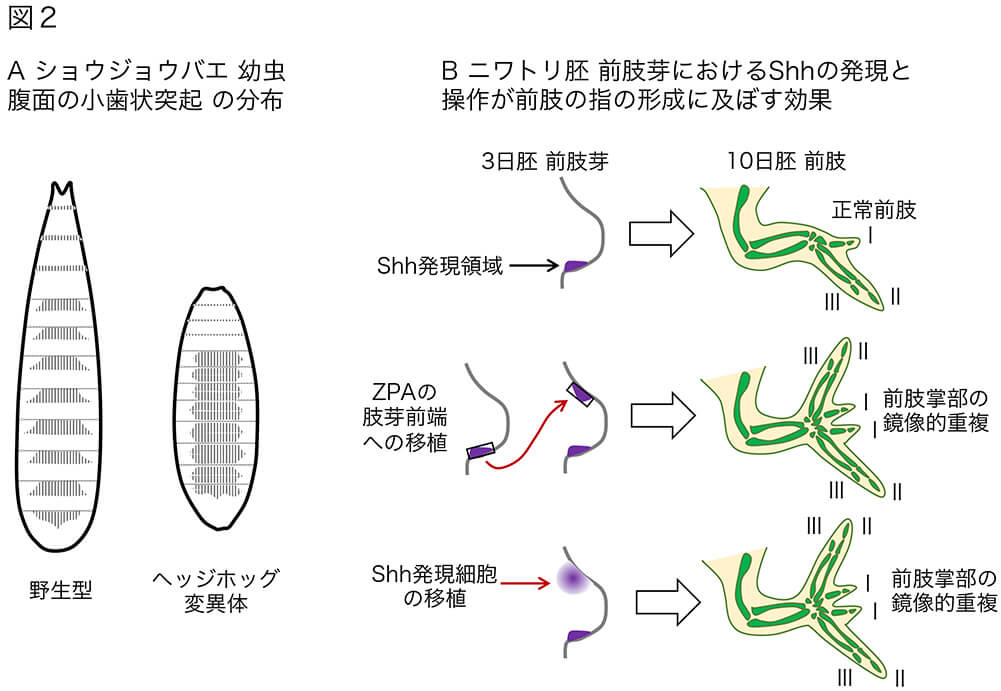
(図2)ショウジョウバエでのヘッジホッグ(Hh) 遺伝子の発見と、脊椎動物肢芽でのソニックヘッジホッグ(Shh)遺伝子の発現。
A..ショウジョウバエ幼虫腹面の小歯状突起の分布。小歯状突起は、縦ハッチングで示している。
B.ニワトリ胚の前肢芽におけるShhの発現と、胚組織の操作が前肢の指の形成に及ぼす効果。前肢芽は、体幹部から突出した半円盤状の組織で、前肢に発達する。10日胚の指を、軟骨の発達(緑色)とともに示している。以前は、ニワトリ前肢の指は、II(人差し指)、III(中指)、IV(薬指)からなると考えられていたが、現在は、恐竜の場合と同じく、I(親指)、II、IIIの構成だというのが定説である。なお、ニワトリの後肢は、I, II, III, IVからなる4本指である。
では、脊椎動物では、ソニックヘッジホッグ(Shh)遺伝子は胚のどこで発現されているのでしょうか?ニワトリ胚でそれを調べていたClifford Tabinのグループは、ニワトリ胚の肢芽(伸びて、手=前肢や足=後肢のもとになる、胴体から突き出た半円盤状の組織)の、後端部分で強く発現されていることに気づきました[文献9]。実は、肢芽後端は、別の胚の肢芽の前端に移植すると前後が反転したもう一つの掌を作ること(図2B)を、それよりも20年ほど前にJohn W Saundersが示していた組織でした [文献10]。Saundersは、肢芽のその領域を、zone of polarizing activity (ZPA; 直訳=極性化活性帯)と呼びました。Tabin達は、ZPAの活性はShhタンパク質の分泌に対応していると考え、Shhを分泌する培養細胞を作りその塊を肢芽の前端に移植すると、ZPAを移植した場合と同じく、重複した掌を持った肢ができました。多くの実験は前肢芽(前肢のもと)で行われましたので、図2Bは前肢芽での実験結果を示しています。ニワトリの前肢はI (親指)、II (人差し指)、III (中指)の3つの指を持っていますが、ZPAやShh分泌細胞を肢芽前端に移植すると、前側から、III, II, I, I, II, IIIの指の配置が見られます。これらのことから、当初は、Shhは肢芽の後側を決める因子だと考えられました。しかし、指の数が多い(5本)マウス胚を持った実験から、Shhの下流で働く転写因子に、指を作ってゆく積極的な作用があることがわかりました。
その話を始める前に、Shhのシグナルを、その強度に応じて転写活性化と転写抑制に変換する、Gli転写因子群について説明しておきます(図3)。この転写因子群は、Gli1, Gli2, Gli3からなり、いずれも、GA[A/C]CACCCA配列に結合して[文献11]転写制御を行います。Gli1はShhシグナル強度を反映して転写を活性化しますが、Gli2, Gli3は、Shhシグナル強度が強い時には転写活性化因子として働く一方、Shhシグナルが低い状態では、強い転写抑制因子として作用します。Gli2, Gli3は、DNA結合領域の両側に、転写活性化ドメインと転写抑制ドメインを併せ持っており[文献12]、これら2つのドメインの作用を、Shhシグナル強度に応じて使い分ける仕組みを持っているのです。
ただし、Gli2とGli3の間には大きな違いがあって、Gli2はShhシグナルがかなり低くなるまで、転写活性化因子として働くのに対して、Gli3の方は、Shhシグナルが少し低くなると、転写抑制因子として働くようになります。このことから、概ね、Gli2は転写活性化因子、Gli3は転写抑制因子として作用することが多いのです。図3Aは、転写活性化ドメイン/転写抑制ドメインを切り出してその活性を調べたデータ[文献12]と、さまざまな胚組織での状況証拠をもとにした、Gli1/2/3による転写活性化と抑制に関するイメージ図です。とはいえ、実際の状況を概ね説明できます。
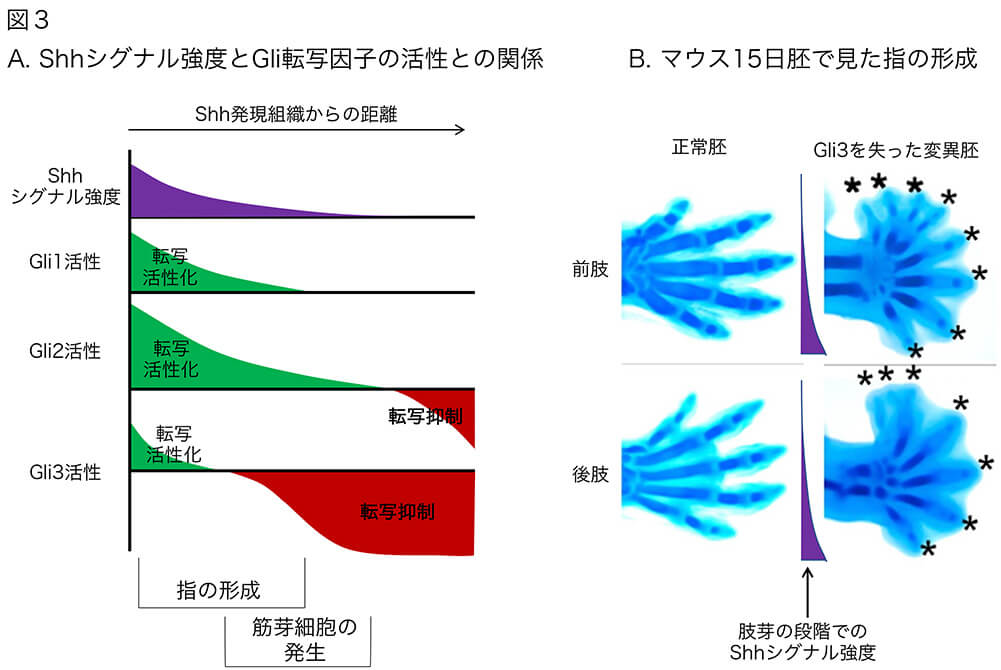
(図3)Shhシグナルに応じて転写制御機能を変化させる転写因子、Gli1, Gli2, Gli3の特性と、その指の形成への反映。Gli3はShhシグナルが低下するとすぐに強い転写抑制活性を発揮し、Gli1, Gli2による転写活性化にブレーキをかける。このことが、指の本数を5本前後とする機構を担っている。Aは、転写制御活性のイメージ図。Bは、文献13のFig. 3による。
Gli3を失った変異体マウス胚では、Gli1/2の転写活性化能に応じて、掌の後側(ZPA側)から前側に向けてどんどん指の数を増やしていって、7〜8本の指を持つことになります(図3B,★; 図のデータは、文献13 Fig. 3による)。つまり、正常胚ではShhシグナルがある程度低下したあたりで、Gli3の強力な転写抑制効果がGli1/2による転写活性化を打ち消し、その結果として、指の数の増加が5近辺で停止したのです[文献14]。別の表現をすれば、指の数は5に決まっているわけではなく、Shhシグナルに呼応した活性化機構と抑制機構がせめぎあって、指が5本前後のところで力が拮抗した結果であるということになります。パンダの6本指、両生類の手の4本指などは、転写活性化機構と抑制機構のバランスの違いを反映しているのかもしれません。
C. 邪魔な抑制転写因子Gli3の働きを抑えて活性化機構を助けるマイクロRNA
肢芽の場合のように、Shh分泌組織と作用する相手の組織とが近接している場合には、Shhシグナルが十分に強いためにGli1/2がGli3の抑制を受けずに済み、制御標的遺伝子の転写を活性化する余地が十分にあるのですが、両者が離れている時には、そのままではGli3の抑制効果が勝ってしまいます。
例えば、軟骨や筋肉を生み出す、神経管の両側に位置する中胚葉組織である体節は、脊索や神経管の底板から分泌されるShh(図5B)シグナルを受けて発達します。(体節については、VOL2でも述べています)。特に体節の中で外側(遠位)に位置する皮筋節から筋芽細胞を生み出すには、Gli1/2による転写活性化が不可欠です。もしGli3の転写抑制作用が働くと、筋芽細胞はできなくなります。筋芽細胞ができるかどうかは、転写因子Myogenin (Mgn) 遺伝子の発現の有無でわかります。胚組織は、このような問題を解決するための巧妙な手段を持っています。それが、マイクロRNA(miRNA)と呼ばれる、20塩基前後の短いRNAです。
[miRNAには数100種類が確認されています。多くのmRNAは、3’側の非翻訳領域にいずれかのmiRNAと相補的な配列を持っており(図4)、miRNAが結合すると、いくつかのプロセスを踏んでmRNAが分解され、もとの遺伝子がコードするタンパク質が作られなくなります。]
Gli3遺伝子の場合は、mRNAの3’側の非翻訳領域に miR-133aというmiRNAが結合すると、Gli3 mRNAが分解されるのですが、そのmiR-133aが体節で発現されているために、体節でのGli3の作用はほとんどなくなり(図5A)、Gli1/2の転写活性化機構が存分に働くことになります。その(正常な)状態では、体節の細胞は増殖して大きくなるとともに皮筋節特有のPax3, Pax7などの転写因子遺伝子、また骨格筋を生み出すための転写因子遺伝子Myogeninなどを発現します(図5B、胚左側)[文献15]。
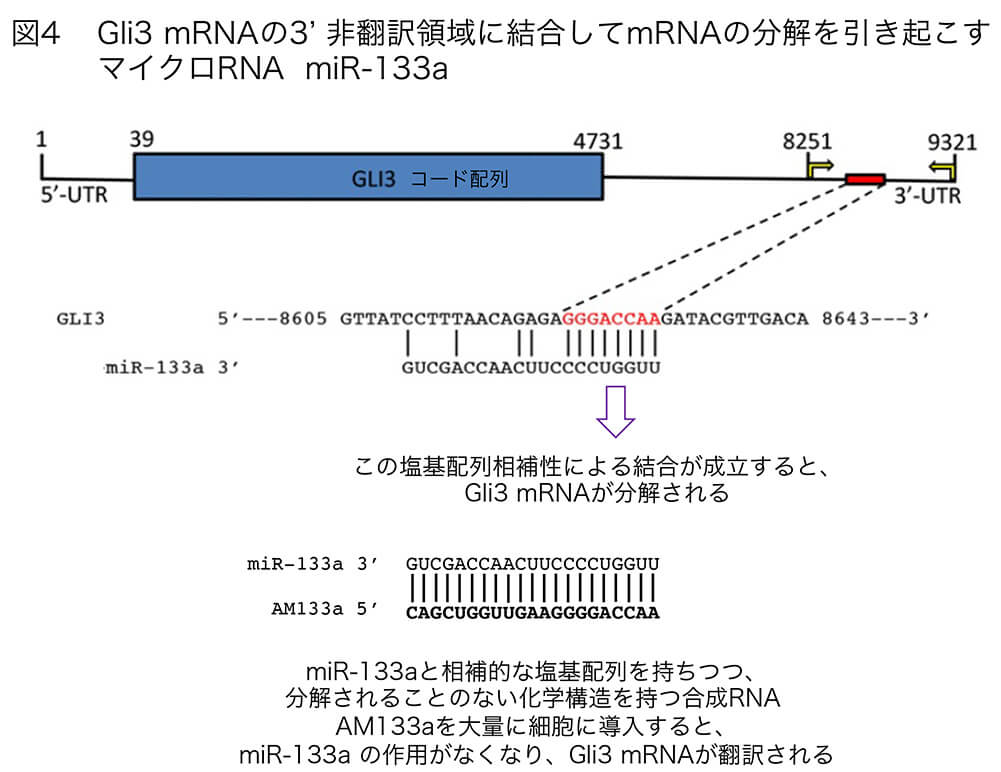
(図4) Gli3 mRNAとmiR-133aを例にした、mRNAとマイクロRNAの結合を介した、mRNAの分解による「転写後制御」。文献 15のFig. 3Eを改変。mRNAの多くは、3’側の非翻訳領域(UTR, untranslated region)に、何れかのマイクロRNAと相補的な配列を持つ。図では、赤字で示したGGGACCAAがmiRー133aと相補的で、その部分で結合する。この配列をシード(seed)配列という。この結合にミスマッチ(A-U, G-C以外の塩基対)がなければ、この部分で3‘ UTRが切断される。ミスマッチが生ずれば、polyA配列を分解するシステムが作動して、このmRNAからpolyAを除去する。いずれの場合でも、それらのmRNAはpolyAを失い、急速に分解される。AM (anti-microRNA) RNAは、マイクロRNAと相補的な配列を持つ安定化された合成RNAである。リボースの2’OHをすべて2’O-methylとすること、いくつかのリン酸基をチオリン酸基で置き換えることによって、RNAの安定性を確保する。
では、miR-133aが体節の細胞で働かないようにしたら(つまり、Gli3が転写抑制活性を発揮したら)。どうなるでしょうか?これを調べるには、antisense micro(AM)-133a 合成RNAを大量に細胞内に導入します。AM-133aはmiR-133aと相補的な塩基配列を持つとともに、分解されぬようポリヌクレオチド骨格に修飾を加えたもので、miR-133に強力かつ安定に結合して、miR-133aの働きを妨害します(図4)。その結果、Gli3が合成されてその転写抑制活性がGli1/2の転写活性化能を凌ぐために(図5A)、体節は小さくなり、Pax3/7の発現細胞数も低下します(図5B(a)(b)、胚右側)。そして、骨格筋を生み出す転写因子Myogeninの遺伝子が全く発現されなくなります(図5(C)、胚右側)。このことから、Gli3の活性をmiR-133aが抑制することが、筋芽細胞の発生に必要だったことが確認されます。
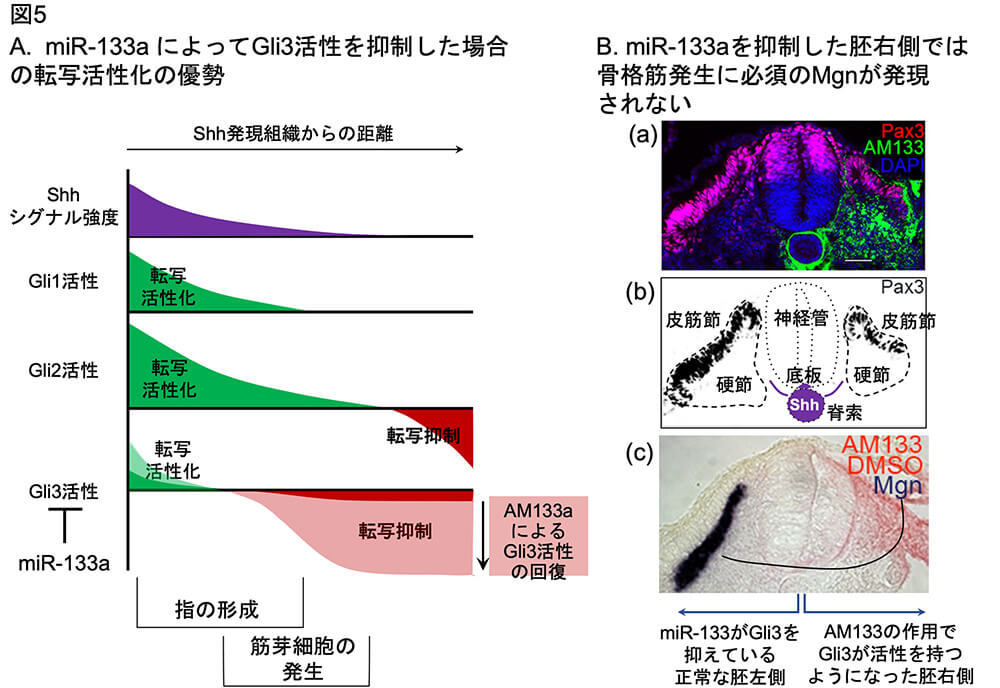
(図5) 体節の中の皮筋節細胞がShhシグナルを受けて筋芽細胞を発生させるーーこのために、体節ではmiR-133aの作用によって転写因子Gli3の発現を低下させる。
A.miR—133aの作用によって低下したGli3の活性を濃い色で示す。AM133aによってmiR-133aを阻害することによって回復したGli3の活性を淡色で示す。B. Gli3の活性化による骨格筋発生の阻害。データは、文献15 Fig. 2, Fig. 4による。体幹部の横断面:胚左側は正常な発生(Gli3が抑制されている); 胚右側はAM133aによってGli3が脱抑制されている。(a) 皮筋節と神経管背側で発現される転写因子Pax3を免疫染色(マゼンタ)。AM133aの分布を緑色で示す。(b) (a)の画像から、皮筋節でのPax3の発現データを抽出して黒で描出。そのほか、組織名とShh分泌源(紫色、脊索と底板)を示す。(c) 筋芽細胞の発生に必要なマイオジェニン (Mgn) のmRNAを検出。胚右側ではMgnの発現が完全に失われている。AM133の分布を橙色で示す。
このように、抑制機構をさらに(場所限定で)抑制するという手口は、発生過程のみならず、体の恒常性を維持する機構にもよく使われます。冒頭にのべた型紙の例えで言えば、抑制機構が作る型紙に新しいパターンの孔を穿って、活性化機構を働かせたことになります。その中で、miRNA達は大きな働きをしています。
[miRNAは数100種あると述べましたが、細胞種ごとにそれらの発現パターンは異なっています。細胞内で作られたmiRNAの一部は、エクソソーム(exosome)と呼ばれる、細胞から出芽するようにして作られる小胞の中に包み込まれて細胞外に放出され、さらにその一部は血流によって運ばれます。それらの小胞は、他の細胞の細胞膜と融合して、その細胞に取り込まれることもあるようです。エクソソームによって運ばれるmiRNAは、細胞間のコミュニケーション(情報伝達)の一つの方法だとみなされています。
がん細胞では、miRNAの発現パターンが正常細胞とは異なっており、それががん細胞固有の性質にも関わっているのではないかとも考えられています。がんのタイプによって、miRNAの発現パターンは大きく異なり、それが血流中のエクソソームの中のmiRNAのパターンにも反映されます。最近、『血液を分析することによって、ガンのタイプをかなりの精度で推定することができる』といった記事を目にしますが、それは、血液中のエクソソームの中のmiRNAを分析しているのです。]
引用文献
[1] Monod J. From enzymatic adaptation to allosteric transitions. Science. 1966 154(3748):475-83. doi: 10.1126/science.154.3748.475.
[2] Spemann H, Mangold H. Über Induktion von Embryonalanlagen durch Implantation artfremder Organisatoren, Arch. Mikrisk. Anat. Entwichlungsmech. 1924 100:599-638.
[3] Holtfreter JF. Reminiscences on the Life and Work of Johannes Holtfreter. 1985 Plenum Press.
[4] Holtfreter JF. A new look at Spemann's organizer. Dev Biol, 1988 5:127-50. doi: 10.1007/978-1-4615-6817-9_4.
[5] Sasai Y, Lu B, Steinbeisser H, Geissert D, Gont LK, De Robertis EM. Xenopus chordin: a novel dorsalizing factor activated by organizer-specific homeobox genes. Cell. 1994 79(5):779-90. doi: 10.1016/0092-8674(94)90068-x.
[6] Sasai Y, Lu B, Steinbeisser H, De Robertis EM. Regulation of neural induction by the Chd and Bmp-4 antagonistic patterning signals in Xenopus. Nature. 1995 376(6538):333-6. doi: 10.1038/376333a0.
[7] Camus A, Perea-Gomez A, Moreau A, Collignon J. Absence of Nodal signaling promotes precocious neural differentiation in the mouse embryo. Dev Biol. 2006 295(2):743-55. doi: 10.1016/j.ydbio.2006.03.047.
[8] Nüsslein-Volhard C, Wieschaus E. Mutations affecting segment number and polarity in Drosophila. Nature. 1980 287(5785):795-801. doi: 10.1038/287795a0.
[9] Riddle RD, Johnson RL, Laufer E, Tabin C. Sonic hedgehog mediates the polarizing activity of the ZPA. Cell. 1993 75(7):1401-16. doi: 10.1016/0092-8674(93)90626-2.
[10] Saunders JW, Gasseling M. Ectodermal-mesenchymal interaction in the origin of limb symmetry. In Epithelial-Mesenchymal Interaction, R. Fleischmayer and R. E. Billingham, eds. 1968 Williams and Wilkins, pp 78-97.
[11] Sasaki H, Hui C, Nakafuku M, Kondoh H. A binding site for Gli proteins is essential for HNF-3beta floor plate enhancer activity in transgenics and can respond to Shh in vitro. Development. 1997 124(7):1313-22. doi: 10.1242/dev.124.7.1313.
[12] Sasaki H, Nishizaki Y, Hui C, Nakafuku M, Kondoh H. Regulation of Gli2 and Gli3 activities by an amino-terminal repression domain: implication of Gli2 and Gli3 as primary mediators of Shh signaling. Development. 1999 126(17):3915-24. doi: 10.1242/dev.126.17.3915.
[13] Hayashi S, Akiyama R, Wong J, Tahara N, Kawakami H, Kawakami Y. Gata6-Dependent GLI3 Repressor Function is Essential in Anterior Limb Progenitor Cells for Proper Limb Development. PLoS Genet. 2016 12(6):e1006138. doi: 10.1371/journal.pgen.1006138.
[14] Lopez-Rios J, Speziale D, Robay D, Scotti M, Osterwalder M, Nusspaumer G, Galli A, Holländer GA, Kmita M, Zeller R. GLI3 constrains digit number by controlling both progenitor proliferation and BMP-dependent exit to chondrogenesis. Dev Cell. 2012 22(4):837-48. doi: 10.1016/j.devcel.2012.01.006.
[15] Mok GF, Lozano-Velasco E, Maniou E, Viaut C, Moxon S, Wheeler G, Münsterberg A. miR-133-mediated regulation of the Hedgehog pathway orchestrates embryo myogenesis. Development. 2018 145(12):dev159657. doi: 10.1242/dev.159657.
サムネイルは、文献13 Fig. 3より
バックナンバー
VOL.4 胚のいつ、どこで、何を発生させるのかには欠かせない抑制機構
VOL.8 動物の形の多様性という名の変奏曲集I 目と顔と手
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)