VOL.8 動物の形の多様性という名の変奏曲集I 目と顔と手
近藤寿人(JT生命誌研究館 顧問・表現ディレクター)
動物の様々な形の妙には心を奪われます。そのことから、「多様性」がしばしば生物学の中で熱く議論されます。しかしその多様性を生み出す、厳然とした基礎ルールがあることが論じられることは、あまりありません。音楽に例えてみましょう。変奏曲を構成するそれぞれの変奏を聞くと、多様な表現が駆使されていて飽きることはありませんが、ある主題(長い音列、基礎パターン)の華麗な展開の集成からなっています。動物の形の多様性というのは、いわば変奏の多様性に例えられる、ある枠の中の多様性なのです。今回からしばらくは、その多様性の基礎となる主題を意識しながら、「形」という変奏を楽しみましょう。

(図1)ハラビロカマキリ(メス)力強い大きな手を持つ。(撮影・筆者)
図1の写真は、先日、生命誌研究館の近くの舗装の上を歩いていたメスのハラビロカマキリです。「カマキリの顔(頭)は前から見ると逆三角形で、上辺の両側に大きな目があり、下のすぼまったところにある口に、頑丈な手で捕らえられた餌の虫が運ばれます」という文章は、多くの方に難なく受け入れられるのではないでしょうか。このことには、私たちの体の共通性に関わる幾つかの「変奏の主題」が重なっています。
A.視覚情報から脳がとらえる目と顔
その一つは、私たち(少なくとも陸上の脊椎動物)には、視覚を介した情報の中から、「目、そして顔」を認識する脳の回路が、生まれながらにして備わっているらしいということです。カマキリの目も顔も、その形は人間のものとは形は似ても似つかないものです。でも、目は目と認識され、またそのことは幼児にも納得して受け入れられています(トンボの目玉は大きな目玉)。子供をハラハラワクワクさせるテレビ番組「仮面ライダー」の顔は、代々、異なった昆虫の顔を模していて、人間のものとはかけ離れていても「顔」は「顔」です。
外界を認識できるようになった乳幼児は、母親の目を見つめて微笑みます。また、猿であれ熊であれ、野生の動物から逃れる時には「目を見るな」と言われます。これは人間以外の動物にも、人間と同様に「目」を視覚情報の中で認識する脳機能が備わっていることの反映です。
脳機能には、一対の円を顔の中の一対の目と認識する仕組みがありそうです。確かに、一対のヘッドライト(時に丸いヘッドライト)を持つ自動車を前から見ると顔のように感じます。自然界に目を移すと、立派な蝶や蛾の中には翅に鱗粉で大きな円を描くものが少なくありません(図2)。これは、大きな一対の円で、大きな一対の目を模して、「こんなに大きな顔を持った大きな動物なのだぞ」と、捕食者を威嚇するためだと言われています。本当にそうだと示す実験事実があるのかどうかは、筆者には定かではありませんが。

(図2)クジャク蝶。大きな蛇の目紋は、目を模すと言われている。
【出典】https://commons.wikimedia.org/wiki/File:Tagpfauenauge_(Inachis_io)_d1_2.jpg
B.太古から伝わる目の発生の基本制御
脳の視覚情報処理の中に、目や顔(頭)を認識する回路(機構)が備わっているのはうなずけることです。「目」という機能組織を発生させるための基本的な転写因子(主題に例えられる)は、動物の長い歴史の中で同じものが用いられています。(研究者としての)私たちは、脊椎動物の、水晶体をはじめとする目の組織(視覚系)の発生では、Sox2とPax6という2つの転写因子が一緒に(複合体を作って)、様々な段階で作用することを示しました[文献1-3]。(Sox2とPax6は、「発生生物学の静かな革命 VOL.2 細胞系譜の再検討」の中で、水晶体を生み出す基礎となる転写因子として既に登場しています。)
一方、Walter Gehringは、ショウジョウバエで目の形成に必須の遺伝子であるeyelessがコードする遺伝子が、脊椎動物のPax6に相当すること、そして、Pax6がホタテガイの眼点(光受容器)から脊椎動物の目に至るまで、常に目の組織の発生に必須の転写因子であることを示し、大きな反響を呼びました[文献4,5]。
さらに、脊椎動物以外でも、目の発生でPax6が働く時には、Sox2に相当する転写因子(ショウジョウバエ ではSoxN)がPax6と一緒に働いているらしいという状況証拠が集まってきました。そのことを確かめたいというGehring氏からの誘いがあって、次の共同研究を実施しました。水晶体を満たすクリスタリン タンパク質の一つであるδ―クリスタリンを作るための遺伝子を働かせる、DC5エンハンサーは特に詳細に研究されていて、Sox2とPax6が同時に作用しなければ、活性を持たないことが確認されています[文献2]。共同研究では、ニワトリのδ―クリスタリン遺伝子DC5エンハンサーをショウジョウバエの体に入れ(トランスジェニック・ショウジョウバエを作る)、体内のどこで活性を持つかを調べました[文献6]。
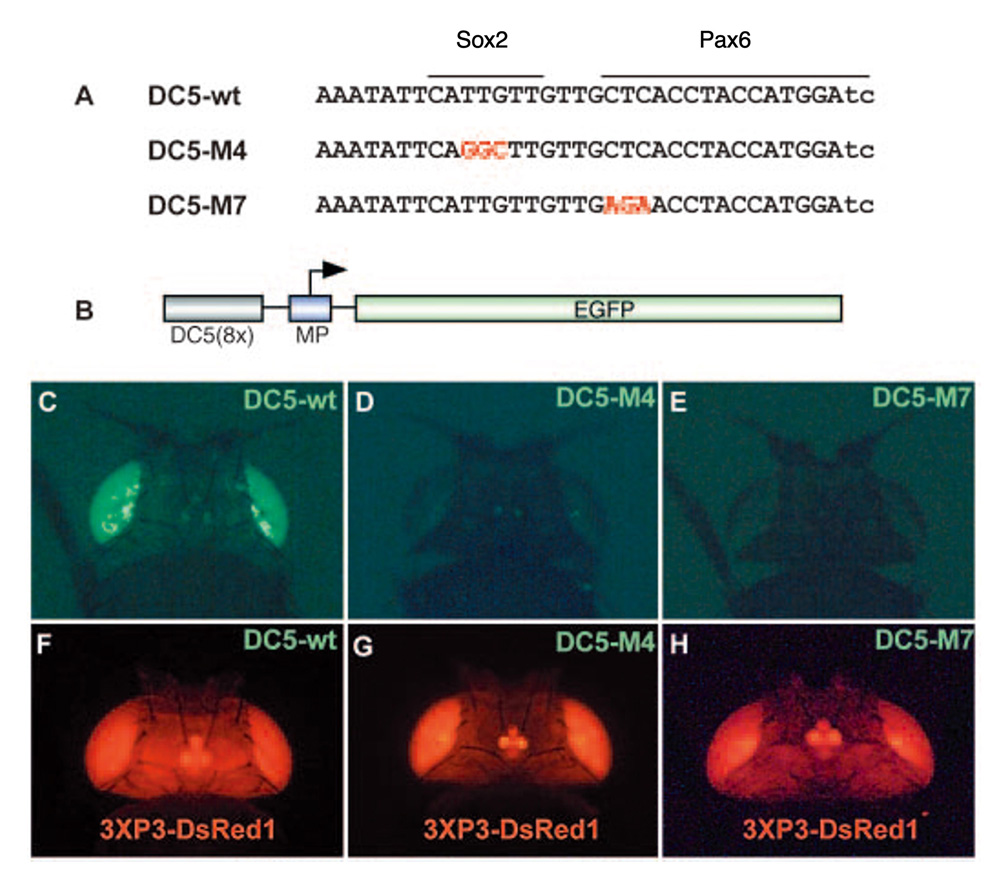
(図3)Pax6とSoxで活性化される、ニワトリδ-クリスタリン遺伝子DC5エンハンサー(ニワトリでは水晶体で活性化される)をショウジョウバエに導入すると、複眼で活性化される。A. DC5エンハンサーの塩基配列と、その配列上でのSox2とPax6の結合領域。wtは野生型配列。M4, M7は、Sox2, Pax6が結合できない変異体の塩基配列。B. ショウジョウバエの中でDC5エンハンサーが活性を持つと、緑色蛍光タンパク質EGFPが発現され、緑色の蛍光を発するように設計された遺伝子の構造。この遺伝子を持ったトランスジェニック ショウジョウバエが作られた。C〜E. 野生型DC5エンハンサーは複眼で活性を持ち、緑色の蛍光を放った。しかし、M4、M7変異体は、全く活性を持たなかった。F〜H. 同時に導入した、目と神経系で発現する遺伝子の発現。遺伝子導入はうまく行ったことが赤色蛍光タンパク質の発現によって確認された。[文献6] より。
結果は明確で、ショウジョウバエの複眼でDC5エンハンサーが強く活性化されること(図3では、緑色蛍光タンパク質が発現され、緑に光っている)がわかります。Sox因子が結合できない変異(M4)、あるいはPax因子が結合できない変異(M7)を持ったエンハンサーは全く活性を持ちませんでした。つまり、DC5エンハンサーがショウジョウバエの目で活性化されるためには、ニワトリの目の場合と同様、SoxN(Sox2)とPax6が、図3Aに示したDNA配列の決まった場所に結合しなければならないのです。
同じ「目」だといっても、ニワトリは水晶体で光を集めて像を網膜に投射する単眼、ショウジョウバエは、多数の視細胞からなる複眼で、構造は全く違います。それにも関わらず、これほどにも異なった、脊椎動物と昆虫の目が、同じ”Sox2+Pax6”という主題からの変奏というべき関係にあることが明らかになりました。
C.目と顔・脳のコネクション
動物の頭の方というのは、概ね、その動物が通常移動してゆく方向の端の部分を指します(直立しているヒトは例外ですが)。また、光受容器(視覚感覚器)である目があるのも、ほとんど例外なくその「頭の方」です。動物が光に反応してその方向に進むという基本的な行動パターンが、動物の系統発生のかなり初期から備わっていたのでしょう。
しかし、光受容器である目があっても、それだけでは顔(頭)とは言えません。その一対の目を一部として包含する、より大きな組織構造があって初めて「顔(頭)」なのです。そのような組織構造はなぜできるか?それはその中に脳ができるからです。非脊椎動物の神経系は、概ね梯子状に体の前後左右を結びつける神経索(Nerve cord)という繰り返し構造からなります。脊椎動物の神経系は神経管という構造を持ちますが、機能的には左右に分かれているので、梯子状神経系と相同だとみなされます。それらの「頭の方」に脳ができます。光受容器のニューロンから出る視覚情報を処理する機能が頭の方の神経系で発達して、それが「脳」という、かさ高い神経組織となり、脳を収納する前端領域として、頭部(前から見ると顔)を生み出したというのが、有力な仮説です。それを示唆するのが転写因子Otx2という、第2の主題です。
一言で言えば、脳も、光受容器(目)の神経細胞も共通して、転写因子Otd(ショウジョウバエでの呼称)=Otx(脊椎動物での呼称)を発現し、それらの転写因子の作用に依存して発生するということです[文献7]。光受容器の観点から述べれば、光受容器全体は、Sox2とPax6に依存して発生し、その中の神経系(脊椎動物では網膜)は、さらにOtx2による制御を必要とするというのが、これから述べることの大まかな要約です。
コラム 遺伝子の名前について
動物の発生に関わる遺伝子の多く(半分以上)は、ショウジョウバエの変異体の名前に由来しています。”orthodenticle”というのは、Christiane Nüsslein-Volhard(ニュスライン-フォルハルト)と、Eric Wieschaus (ヴィーシャウス)によって実施された、ショウジョウバエ の発生に関わる変異体の網羅的なスクリーニングの中で見出された変異体の一つです。(発生生物学の静かな革命VOL 4「胚のいつ、どこで、何を発生させるのかには欠かせない抑制機構」をご参照下さい)。この変異体の外見的な特徴の一つが、幼虫が匍匐前進するために、それぞれの節の腹側にもつ小歯状突起(denticle)の配列の変化でした。小歯状突起のバンド(denticle bands)の幅が狭くなり、直線的(ortho)に見える突然変異体だったことから、このように名づけられました。その後の研究で、(1)この変異体は神経系、特に幼虫の脳の形成に欠陥があること、また、(2)この変異体の原因遺伝子(その遺伝子の活性が変化――多くの場合、失活――することによって変異体の表現型が生まれた元の遺伝子)が、Hox因子群とは別のタイプのホメオドメインを持つ転写因子であることも明らかになりました。遺伝子の名前は、変異体の名前から来ることが多く、この遺伝子はorthodenticleと呼ばれ、Otdと略されます。Otd遺伝子がコードする転写因子タンパク質がOtdです。
ショウジョウバエにある遺伝子の多くは、それに相当する遺伝子(ホモログ遺伝子)が脊椎動物にも存在します。Otdに相当するものとして2つの脊椎動物遺伝子、Otx1, Otx2が見出されました。脊椎動物の転写因子の遺伝子名には、番号の前の3文字目にxをつけることが多いのです。先に述べた、Sox2, Pax6も同様です。Otxは、Otdに似た転写因子の遺伝子なので、Ot+xと名付けられました。脊椎動物の2つのOtx遺伝子(Otx1, Otx2)は同様の働きをしていますが、Otx2が主となって働いています。ショウジョウバエのゲノムの中にもさらに、Otdに似たOtp(orthopedia)というもう一つの遺伝子が見つかりました。プラナリアの脳では、2つのOtx遺伝子と1つのOtp遺伝子がセットになって働いています(後述)。
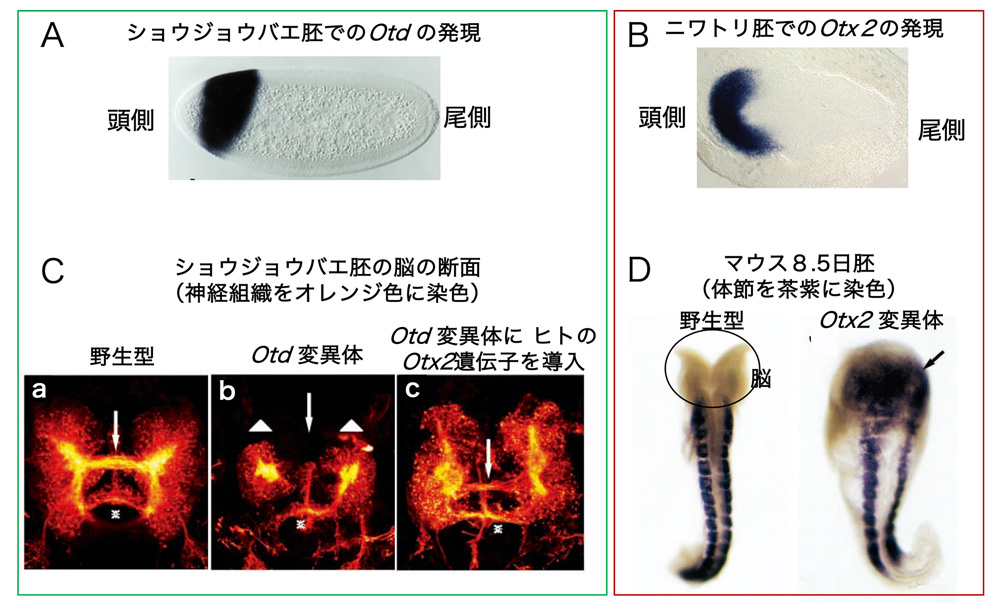
(図4)ショウジョウバエOtdと、脊椎動物Otx2の発現と機能の類似性。A. ショウジョウバエ胚 頭側領域での、Otd遺伝子の発現(濃青)。発現領域が、将来の頭部にほぼ対応している。[文献8] より、Development誌からの許諾を得て掲載。B. ニワトリ胚でのOtx2遺伝子の発現。発現領域が、将来の頭部にほぼ対応している。(浦田歩、寺元万智子、近藤寿人のデータ)。C. ショウジョウバエOtd変異体の脳組織の欠損と、ヒトOtx2遺伝子による欠損の回復。脳の神経をオレンジ色に染め出している。a. 野生型脳の切片。b. Otd変異体の脳。左右の神経塊(葉 lobe) が貧弱であるとともに、左右の葉をつなぐ神経束(矢印)が欠けている。c. ヒトのOtx2を発現すると、脳のいずれの欠損も回復した。[文献9] より、Development誌からの許諾を得て掲載。D. マウス胚でOtx2を欠損させると、脳(左の野生型胚の楕円で囲んだ部分)が失われる(右)。茶紫の染色は、体節を示す。[文献10] より、Development誌からの許諾を得て掲載。
図4は、ショウジョウバエのOtd [文献7,8]と脊椎動物のOtx2の、胚での発現、そして機能の類似性を示したものです。ショウジョウバエ胚でも(A)ニワトリ胚でも(B)、胚の頭側の端に近い、結構広い領域で発現されていることがわかります。これらの領域が、発生が進むと脳になります。(C)(D)は、これらの遺伝子の変異体を示しています。ショウジョウバエの胚の脳は、結構複雑な構造を持っています(C(a))。Otdの遺伝子活性を失った変異体では、左右の神経組織(葉)が小さくなり(白三角)、左右をつなぐ神経の束(矢印)が失われています(C(b))。Otx2変異体マウス胚では、脳が全くなくなります(D)。ここで重要な実験が行われました。Otd変異体にヒトのOtx2配列を持つDNAを導入してOtx2因子を発現させると、変異体の脳構造の2つの欠陥が回復しました(C(c))[文献9]。つまり、Otd因子とOtx2因子とは、アミノ酸配列の特徴がよく似ているだけでなく、転写制御タンパク質としての機能にも互換性があったのです。
この実験によって、Otd とOtx2という別の動物種の遺伝子が(1)似た塩基配列を持つ、(2)胚の脳を作る場所で発現する、(3)変異体では脳形成がうまくいかないーーという類似性を超えて、同じ機能を持つタンパク質をコードしていることが確認されました。後にも触れることですが、Otd遺伝子とOtx2 遺伝子は数億年も前に別れたものです。それらがコードするタンパク質が、今日でも同等の制御機能を持っているというのは驚くべきことで、現代の多様な動物の脳も、「転写因子Otd/Otx2の制御機能の上に成り立つ」という主題の変奏であることを示しています。
OtdやOtx2遺伝子の単純な変異体の表現型からは、これらの遺伝子が脳の発生に必須の遺伝子であることが明らかになりました。さらにその後、目の組織だけで遺伝子を失活させる(条件的ノックアウト)などの方法で、Otd/Otx2は、目の神経組織(脊椎動物では網膜)の発生に欠かせない転写因子であることが明らかになりました。ショウジョウバエではOtdとその類縁遺伝子であるDveが複眼の光受容細胞のタイプを決定していること[文献11]、マウスの網膜を構成する神経細胞の発生には、Otx2とその類縁遺伝子であるCrxの働きが必須であることなどが明らかになっています[文献12]。
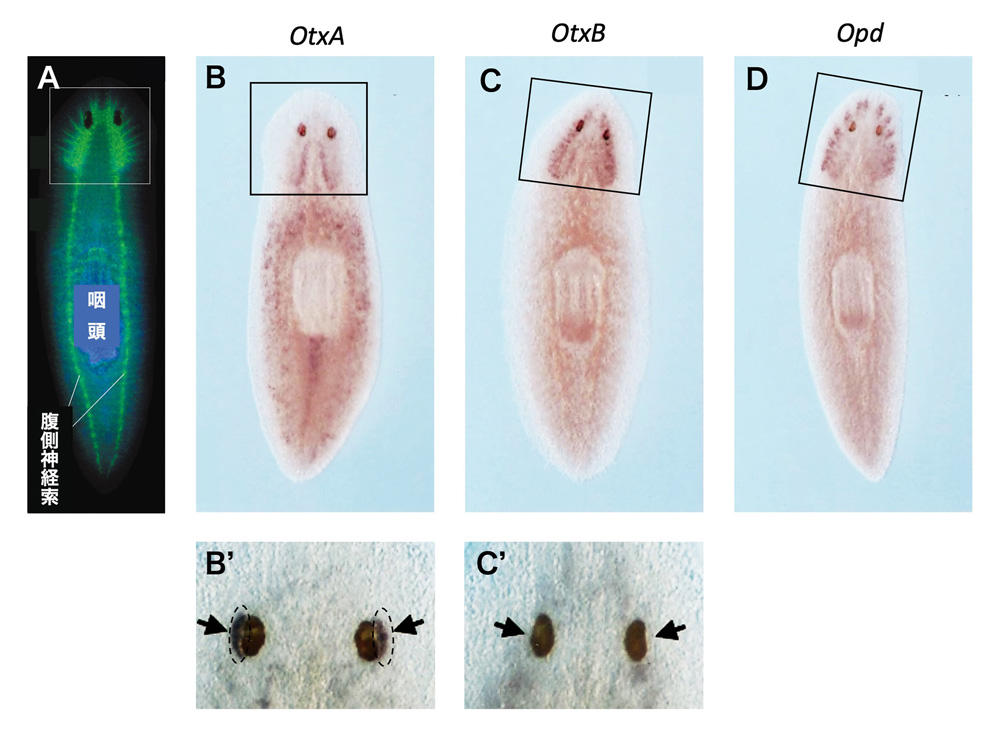
(図5) プラナリアの脳と光受容体神経細胞における、Otx系転写因子の発現。A. プラナリアの神経組織を抗シナプトタグミン抗体を用いて緑に染め出した。脳の部分を矩形で囲った。[文献13] より、著者の許諾を得て転載。BーD. プラナリアでの3つのOtx系遺伝子OtxA、OtxB、Opdの発現を検出(赤茶色)。矩形で囲んだ脳領域での3つの遺伝子の発現を足し合わせると、Aで示した脳の神経の分布パターンを再現できる。B’とC’はB、Cの目の部分の拡大(別の個体)。目(矢印)には色素細胞があり、それはB‘、C’いずれにもある。B’は、その外側の光受容神経(点線で囲んだ)でOtxAが発現されていることを示す。BーD、 B‘、C’は。[文献14] よりSpringer-Natureからの許諾を得て掲載。
脳と目の神経組織での、Otd/Otx転写因子群について、プラナリアの例で詳しく見てみましょう。図5Aは、プラナリアの神経系全体を抗シナプトタグミン抗体で緑色に染め出したものです[文献13]。一対の目は、黒い色素細胞(黒く色が抜けている)の存在でわかります。矩形で囲んだ脳の後方に、左右の腹側神経索が伸び出しています。図5B~Dは、OtxA, OtxB, OtpというOtd/Otxタイプの転写因子遺伝子の発現を、in situ hybridizationという方法で染め出したもので[文献14]、これらから次のことがわかりました。(1)これらの3遺伝子の神経系での発現は、脳の領域(矩形で囲む)に限定されていること。(2)3遺伝子の脳での発現は領域が異なっていて、OtxA, OtxB, Otpの発現を重ねて初めて、Aで示した神経系のうち、脳の神経組織分布を再現できること。
B’、C‘は、OtxA, OtxB,の目(矢印で示す)での発現を拡大してみています(B、Cとは別の個体)。目の神経細胞は、黒い色素細胞の外側に位置しています。OtxAは、その神経細胞で発現されている(B’)のに対して、OtxBは発現されていません(C’)。このように、Otd/Otxタイプの転写因子遺伝子は、動物によって多様な使い分けをしながら、脳と視覚系の神経組織の発生に中心的な役割を果たしています。
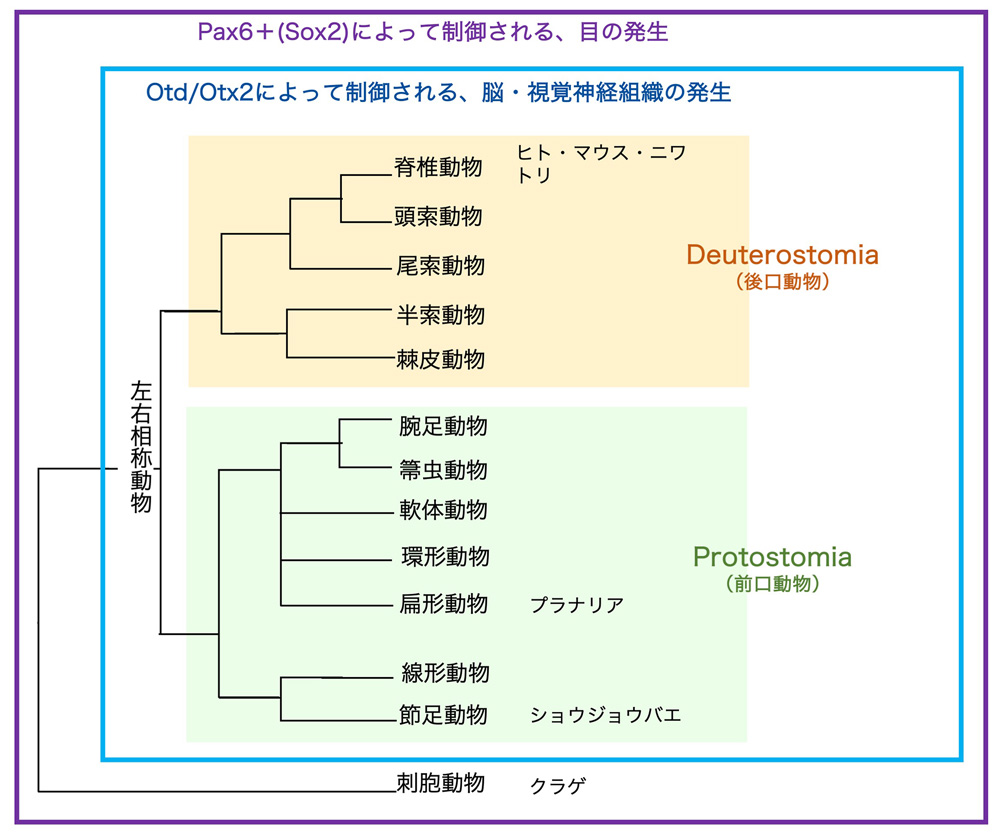
(図6) 本文で登場した動物を、系統樹の上に配置した。大きく隔たった動物系統群であるDeuterostomiaと、Protostomiaを、背景の色を変えて示した。
D.動物界の中で
ショウジョウバエとプラナリアを何気ない素振りで脊椎動物と比較してきましたが、これらの動物はどんな関係にあるのでしょうか。図6の動物の系統樹の上に、登場した動物を置いてみました。(古典的な系統樹は、動物やその胚の形態的な特徴をもとに描かれましたが、様々の動物のゲノム配列が網羅的に解析されて得られた情報をもとにして、系統樹は大幅に再編されました。図6は、それをもとにした略図です。しかし、以前の分類名は実際の動物の特徴とは齟齬を来しながら残っているのが問題です。これから取り上げるProtostomia、Deutrostomiaは、口が肛門より先にできる、後にできるという意味ですが、それらに分類される動物の発生には、その名に相応しくないものが少なくありません。また、系統分岐図は現存する動物のゲノム配列間の隔り(距離)をもとに描かれたもので、この図の分岐の通りに系統が分岐していったと主張するものでもありません)。
動物の大部分は、左右相称動物で、その中で数億年前に別れたとされる、Protostomiaか、Deutrostomiaに属しています。ヒトをはじめとした脊椎動物はDeutrostomia、ショウジョウバエ・プラナリアはProtostomiaですから、それらは数億年前に別れたーーそれにも関わらず、「Pax6+Sox2によって制御される、目の発生」、「Otd/Otx2によって制御される、脳・視覚神経組織の発生」という、体の機能ユニットの形成と転写因子との関係が、2つの大きな系統の分岐前に成立していたこと、そしてその関係が数億年を経て維持されていることは驚くべきことだと感じます。
コラムの中で、「動物の発生に関わる遺伝子の多く(半分以上)は、ショウジョウバエの変異体の名前に由来しています。」と書きました。つまり、これほど隔たったショウジョウバエと脊椎動物の間で、多くの遺伝子が共有されているのです。しかし、共有の仕方は様々です。例えば、ショウジョウバエの変異体がきっかけとなって見出されたヘッジホッグ遺伝子。「発生生物学の静かな革命VOL.4 胚のいつ、どこで、何を発生させるのかには欠かせない抑制機構」で詳しく述べたように、この遺伝子がコードするタンパク質が「分泌されて細胞間のシグナルを担う」ことについては、ショウジョウバエと脊椎動物との間で共通(保存されている)です。しかし、働く場所はショウジョウバエ幼虫では腹側の小歯状突起の形成、かたや脊椎動物では体節や指原基の形成の調節といった具合に関連性がありません。しかし、Pax6+Sox2, Otx2を例として、発生を制御する転写因子の多くは、動物種の大きな隔たりを超えて、体の機能構造の形成と深く結びついています。つまり、体の機能構造は動物種間で形態的には多様に見えますが、それらの発生の基盤となる転写因子の作用を「主題」とした、多彩なしかしあくまでも変奏としての発展の結果なのです。
さて、左右相称動物からはさらに隔たった、刺胞動物ではどうでしょうか。Joram Piatigorskyのグループは、クラゲが持つ(立派な)目の形成では、Pax6の祖先型とも見なされるPaxBが働いていることを示しました[文献15]。「Pax6による目の形成の指定」という機構は、左右相称動物が成立する以前の段階から存在していたことになります。(Sox2相当因子が一緒に働くのかどうかは調べられていない)。一方、Otd/Otx2の方は、クラゲでは筋肉(striated muscle)で発現されているのみで、「Otd/Otx2による脳と光受容体神経の指定」という機構は、左右相称動物の成立あたりから生まれたもののようです[文献16]。
図6を詳しくご覧になった方は、なぜこんなにも形が違う棘皮動物(ヒトデ・ウニ)が、ショウジョウバエよりも遙かにヒトに近いのかと怪訝に思われるかもしれません。最近、ヒトデとその胚での発生に関わる遺伝子の発現が解析されました[文献17]。その結果を一言でいうと、『棘皮動物は「ほとんど頭」からなる動物だ』ということです。Otxをはじめとする、脳・頭部の形成に関わる転写因子の遺伝子は、脊椎動物のものとある程度対応可能な領域分布で発現されていました。これらの動物は決して下等ではなく、私たちと同じく地球上の長い時間の間に変化してきたものたちですから、脊椎動物と棘皮動物の間の遺伝子発現パターンの対応は入り組んでいますが。
E.手
「手」は変奏の主題ではなく、次回への軽い前奏曲です。
前脚を「手」とするかどうかは、脳の判断によるところですが、基本的には、体を支えるのではなく「食」などのために前脚を使う時に、「手」という意識が脳に芽生えるように思います(前脚と手は排他的に使われるものではありません)。前脚が手になるのは、それが「口+顔」に近いことと切り離せないでしょう。
--- 赤ん坊は、手で掴んだものをなんでも口に運びます。箸、フォークなどがない時代や状況では、大人も(霊長類も)手で食べ物を口に運びます。そのようにして食べるおにぎりは美味しいですね。
--- パンダは、「手」で竹を掴んで口に運びます。
--- ラッコは、貝を仰向けのお腹に乗せて、「手」に持つ石で殻を破り、「両手」で貝の身を口に運びます。
--- 猫の「手」も借りたい! ネコ科の動物は、餌を捕らえるために「手」を使います。猫は、ネズミやセミ(結構昆虫食)を「手」で捕らえます。大型のライオンなどは、「手」で大型動物にしがみついて倒し、餌とします。
次回は、掌(手のひら)と指についてお話しするつもりです。
引用文献
[1] Kamachi Y, Uchikawa M, Collignon J, Lovell-Badge R, Kondoh H. (1998). Involvement of Sox1, 2 and 3 in the early and subsequent molecular events of lens induction. Development. 125: 2521-2532. doi: 10.1242/dev.125.13.2521.
[2] Kamachi Y, Uchikawa M, Tanouchi A, Sekido R, Kondoh H. (2001). Pax6 and SOX2 form a co-DNA-binding partner complex that regulates initiation of lens development. Genes Dev. 15:1272-1286. doi: 10.1101/gad.887101.
[3] Inoue M, Kamachi Y, Matsunami H, Imada K, Uchikawa M, Kondoh H. (2007). PAX6 and SOX2-dependent regulation of the Sox2 enhancer N-3 involved in embryonic visual system development. Genes Cells. 12:1049-1061. doi: 10.1111/j.1365-2443.2007.01114.x.
[4] Gehring WJ, Ikeo K. (1999). Pax 6: mastering eye morphogenesis and eye evolution. Trends Genet. 15:371-377. doi: 10.1016/s0168-9525(99)01776-x.
[5] Gehring WJ. (2004). Historical perspective on the development and evolution of eyes and photoreceptors. Int J Dev Biol. 48:707-717. doi: 10.1387/ijdb.041900wg.
[6] Blanco J, Girard F, Kamachi Y, Kondoh H, Gehring WJ. (2005). Functional analysis of the chicken delta1-crystallin enhancer activity in Drosophila reveals remarkable evolutionary conservation between chicken and fly. Development. 132:1895-1905. doi: 10.1242/dev.01738.
[7] Finkelstein R, Smouse D, Capaci TM, Spradling AC, Perrimon N. (1990). The orthodenticle gene encodes a novel homeo domain protein involved in the development of the Drosophila nervous system and ocellar visual structures. Genes Dev. 4:1516-1527. doi: 10.1101/gad.4.9.1516.
[8] Grossniklaus U, Cadigan KM, Gehring WJ. (1994). Three maternal coordinate systems cooperate in the patterning of the Drosophila head. Development. 120:3155-171. doi: 10.1242/dev.120.11.3155.
[9] Leuzinger S, Hirth F, Gerlich D, Acampora D, Simeone A, Gehring WJ, Finkelstein R, Furukubo-Tokunaga K, Reichert H. (1998). Equivalence of the fly orthodenticle gene and the human OTX genes in embryonic brain development of Drosophila. Development. 125:1703-1710. doi: 10.1242/dev.125.9.1703.
[10] Ang SL, Jin O, Rhinn M, Daigle N, Stevenson L, Rossant J. (1996). A targeted mouse Otx2 mutation leads to severe defects in gastrulation and formation of axial mesoderm and to deletion of rostral brain. Development. 122:243-252. doi: 10.1242/dev.122.1.243.
[11] Johnston RJ Jr, Otake Y, Sood P, Vogt N, Behnia R, Vasiliauskas D, McDonald E, Xie B, Koenig S, Wolf R, Cook T, Gebelein B, Kussell E, Nakagoshi H, Desplan C. (2011). Interlocked feedforward loops control cell-type-specific Rhodopsin expression in the Drosophila eye. Cell. 145:956-968. doi: 10.1016/j.cell.2011.05.003.
[12] Yamamoto H, Kon T, Omori Y, Furukawa T. (2020). Functional and Evolutionary Diversification of Otx2 and Crx in Vertebrate Retinal Photoreceptor and Bipolar Cell Development. Cell Rep. 30:658-671.e5. doi: 10.1016/j.celrep.2019.12.072.
[13] Umesono Y, Agata K. (2009). Evolution and regeneration of the planarian central nervous system. Dev Growth Differ. 51(3):185-195. doi: 10.1111/j.1440-169X.2009.01099.x.
[14] Umesono Y, Watanabe K, Agata K. (1999). Distinct structural domains in the planarian brain defined by the expression of evolutionarily conserved homeobox genes. Dev Genes Evol. 209:31-39. doi: 10.1007/s004270050224.
[15] Kozmik Z, Daube M, Frei E, Norman B, Kos L, Dishaw LJ, Noll M, Piatigorsky J. (2003). Role of Pax genes in eye evolution: a cnidarian PaxB gene uniting Pax2 and Pax6 functions. Dev Cell. 5:773-785. doi: 10.1016/s1534-5807(03)00325-3.
[16] Müller P, Yanze N, Schmid V, Spring J. (1999). The homeobox gene Otx of the jellyfish Podocoryne carnea: role of a head gene in striated muscle and evolution. Dev Biol. 1216:582-594. doi: 10.1006/dbio.1999.9522.
[17] Formery L. Pelus P, Kohnle I, Malnick J, Thompson JR, Pitel M, Uhlinger KR, Rokhsar DS, Rank DR, Lowe CJ. (2023). Molecular evidence of anteroposterior patterning in adult echinoderms. Nature. 623, 555–561 (2023). doi: 10.1038/s41586-023-06669-2.
サムネイルは図3より
バックナンバー
VOL.4 胚のいつ、どこで、何を発生させるのかには欠かせない抑制機構
VOL.8 動物の形の多様性という名の変奏曲集I 目と顔と手
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)