VOL.5 再生専用の細胞を用いない、私たちの組織の再生
近藤寿人(JT生命誌研究館 顧問・表現ディレクター)
組織再生の課題
1年ほど前に、「再生力のチャンピオン、イモリとプラナリアのワザ比べ」という研究員レクチャーを行いました。その趣旨は、損傷を受けた組織の再生には、再生専用の幹細胞を準備して再生する仕組み(プラナリア型)と、再生専用の細胞ではなく、既に機能を持った体細胞を使って再生する仕組み(イモリ型)とがあること、そして私たち脊椎動物の組織の再生のほとんどはイモリ型であるということでした。
脊椎動物の組織で、再生専用の細胞を用いて再生するのが確かなのは、骨格筋だけです。骨格筋繊維(多数の骨格筋細胞が融合してできた巨大な細胞)には、再生が必要になった時のために用意された休止状態の衛星細胞(satellite cells、筋芽細胞が骨格筋になる前の段階で休止したもの)が張り付いています。筋繊維が破断されると、衛星細胞が休眠から目覚めて急速に増殖し、骨格筋繊維を再生します。怪我でなくても、例えば肉離れという筋繊維の破断の際に起きる、細胞の反応です。
筋ジストロフィーを患っておられる方は、何らかの原因(デュシェンヌDuchenne型の場合はジストロフィンDystrophinタンパク質の機能不全)で、 筋繊維が破壊され続けるのに対して、衛星細胞による再生が追いつかなくなることから発症します。
それ以外の組織についても、特に再生力に富んだ組織では「再生専用の細胞」があるに違いないと考えられ、その発想の延長線上の空想として「イモリが成体でも再生力に富むのは、身体中に再生専用の幹細胞が分布しているからだ」と考える人さえ出る有様でした。
しかし、最近の研究の進歩(クラゲの蛍光タンパク質を発見した下村脩先生の功績なしでは語れない)で、「どの細胞がもとになって、どのような細胞が生まれたのか」ということを克明に調べることができるようになりました。そのような新しく正確な方法で調べると、脊椎動物ではイモリであっても、ほとんどの場合は再生専用ではない細胞が必要に応じて性質を変えて、損傷を受けた組織を再生することが明らかになりました。
一方で、陸上の脊椎動物では、成体になっても素晴らしい組織再生能力を持つイモリが際立っています。イモリがどのようにして組織を再生しているのかということを詳しく調べることによって、私たちには(そのままでは)実現できない再生過程も、少しの遺伝子操作で実現できるようになりつつあります。脊髄損傷の治癒の例を紹介します。
となると、イモリを用いた再生の研究が、現代の発生研究の最先端の一翼を担うわけですが、それに相応しいイモリの「エース」も登場しています。
今回は、そのあたりのことをお話ししましょう。
肝臓の再生
私たちの肝臓の再生能力は素晴らしいものです。劇症肝炎などで肝臓が大きな損傷を受けた場合でも、三分の一の組織が残っていれば、元の大きさの肝臓を再生できます。生体臓器移植の対象には腎臓、肺、肝臓などがありますが、腎臓・肺などの場合は、ドナーの方の失われた臓器部分は回復しません。しかし生体肝移植の場合は、レシピエントもドナーも肝臓の体積を回復できます。
ギリシア神話に出てくるプロメテウスは、神界から火を盗んで人間に与えた罪で、カウカソス山の頂に縛りつけられ、毎日肝臓を鷲に啄まれる責め苦を負ったのですが、その夜のうちに肝臓を再生するという繰り返しが3万年続いたことになっています。このことを図像化した有名な黒陶杯(図1、バチカン美術館蔵)は、紀元前6世紀のものです。その頃ギリシア人が既に、肝臓の再生能力を知っていたのだとすれば、恐るべきものです。

(図1)アトラスとプロメテウス(黒陶杯550 BC) バチカン美術館所蔵
プロメテウス(右の人物)は火を天上から盗んで人間に与えた罪でゼウスによってカウカソス山に繋がれ、毎日肝臓を鷲についばまれていたが、毎夜肝臓を再生した。
以前は、組織再生には、骨格筋の場合のように、「再生に特化した細胞」によって再生が起きるという考えが広まっていました。特に、肝臓のように再生力が旺盛な(しかも複数種の細胞からなる)臓器の再生には、再生のための幹細胞が働いているに違いないという考え(仮説)が主流で、「肝臓再生のための幹細胞」探しが精力的に行われました。図2Aに示すように、肝臓の自前の細胞種は「肝実質細胞(解毒、アルブミン分泌など、肝臓の機能の中心を担う)」と、「胆管細胞(胆汁の分泌などを担う)」の2種類からなっています。肝臓を取り出すと、血管をはじめとして他の細胞もたくさんありますが、それらは肝臓の外から入ってきたものです。例えばクッパー細胞(Kupffer細胞)は、肝臓に住み着いたマクロファージ(貪食細胞)です。
「肝臓再生のための幹細胞」探しでは、次のようないささか歪んだ論理が使われていました。「もしある細胞を培養してみて、肝臓の2種の細胞が生まれれば、それは再生の幹細胞の証明である。なぜなら、再生は幹細胞をもとにして実現されるものなのだから」。このような基準から、楕円細胞(Oval cells)、Lgr5発現細胞などが、「我こそは肝臓再生の幹細胞なり!」と名乗りをあげていましたが、次の一連の研究からそれらは否定されました。肝臓の再生に、専用の幹細胞が使われること自体が否定されたのです。
研究方法の発展によって、肝臓に損傷を与える前の時点で、肝実質細胞と胆管細胞であった細胞を別の色の蛍光タンパク質(例えば赤と緑)で標識できるようになりました。そうしておいて、肝臓の再生の中間過程や再生が完了した時点で、肝実質細胞や胆管細胞であった細胞がどのように変化したのかを追跡したのです。その結果、最初肝実質細胞であったものが再生された肝実質細胞だけでなく胆管細胞のかなりの部分をしめ、また逆に、胆管細胞であったものが、再生胆管細胞にも、肝実質細胞にもなっていることが分かりました。さらに、再生を始めようとする肝臓では、肝実質細胞も胆管細胞も、2つの転写因子Hnf4a、Sox9を同時に発現する、再生固有の細胞に一度変化することが明らかになりました。この細胞は、胚発生の、肝実質細胞と胆管細胞が分かれる段階では決して現れません。Hnf4a・Sox9共発現細胞が、肝実質細胞も胆管細胞も生み出すという、図2Bで示す結果がもたらされたのです。(文献1〜3)
肝臓の再生にはLgr5を発現する細胞は関与していませんでした。楕円細胞と呼ばれたものは、胆管細胞の一部がそのような形態を取っていたに過ぎません。というわけで、肝臓の再生は、肝実質細胞・胆管細胞をもとにして起きるのです。
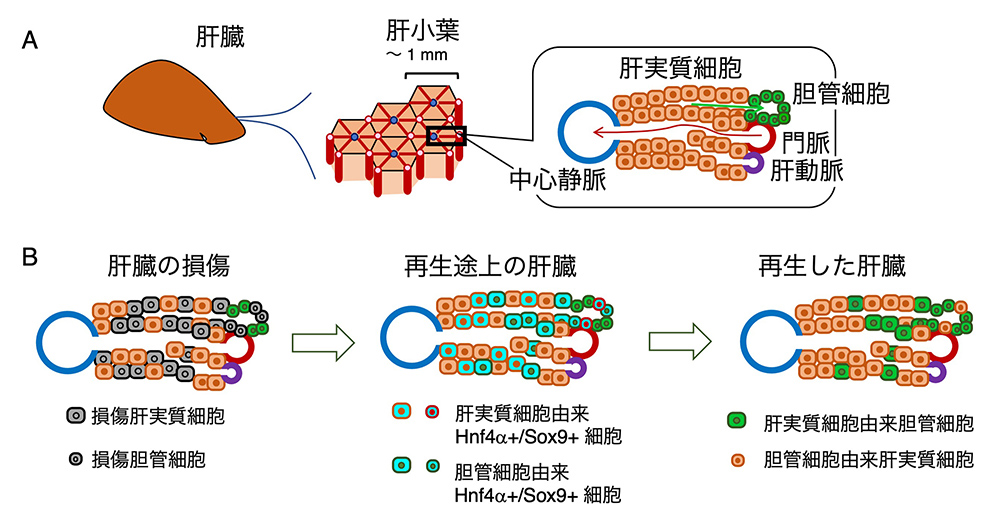
(図2)肝臓の構成とその再生
A. 肝実質細胞と、胆管(上皮)細胞と血管系が作る小葉を単位とした、肝臓の構成。
B. 肝臓の再生に、肝実質細胞と胆管細胞のどちらもが関わる機構。
イモリの水晶体の再生
イモリの眼から水晶体を摘出すると、真黒な虹彩の組織の背側の端から、小さな透き通った水晶体が現れ、これがどんどん大きくなって、1ヶ月後にはほぼもとの大きさにまで成長して、水晶体が再生されます。19世紀の末には既に知られていた(文献4, 5)この現象は、「再生は幹細胞(再生専用の細胞)によって起きる」ことを、強く支持するものと見なされて来ました。なぜなら、眼を一周する虹彩の中で、背側の端からしか水晶体が再生しないからです。虹彩背側に再生専用の細胞が局在しているに違いないという考えが長い間支配的でした。しかし、私たちの研究でその古い考えを覆しました。その概略を紹介します。
イモリの眼の水晶体の再生は、2段階で起こり、それぞれ別のシグナル因子が作用していることを示しました。(シグナル因子は分泌タンパク質で、分泌源の細胞から広がり、それを受け取った細胞が変化します)。第1段階は、Fgf2因子、第2段階はWnt2b因子です。Wnt2b因子は虹彩背側だけから分泌され、しかもあまり拡散しない因子なので、そのことが、虹彩の背側からしか水晶体が再生されない仕組みになっているのです(文献6, 7)。
第1段階の組織の変化を図3に示します。水晶体を摘出しなくても、眼房に少量のFgf2因子を一度注入するだけで、水晶体再生の全プロセスが開始されます。第1段階では、虹彩全体で細胞増殖が始まり、組織が厚ぼったくなります。水晶体はFgf2をふんだんに含んでいますから、水晶体が損傷を受けた時に漏れ出るFgf2が、水晶体再生の第1段階を引き起こすのでしょう。その後再生過程は第2段階に入り、正常な水晶体を持ちながらも虹彩背側から第2の水晶体の発生が始まります(文献6)。(その後、第2の水晶体が大きくなると、もとからあった水晶体は、退縮・崩壊を始めます。親は子に道を譲るという自然の摂理が働いているようです)。
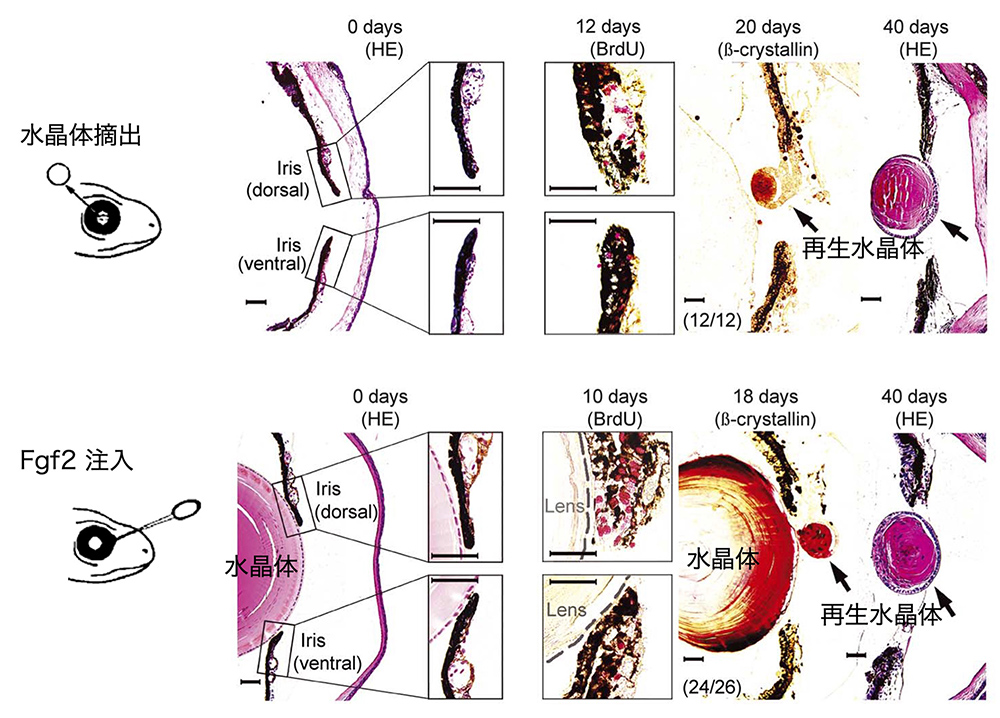
(図3)イモリの水晶体再生
水晶体の摘出でも、眼房へのFgf2因子でも、水晶体再生は同様に開始され進行する。組織切片で組織の変化を示しており、水晶体は赤く染め出されている。10〜12日の切片中の赤は、DNA合成の進行を示している(BrdU標識)。12日あたりまでが、水晶体再生の第1段階、それ以降が第2段階。再生途上の水晶体を矢印で示す。文献6から、Elsevierの許可を得て転載。
第2段階の開始時で虹彩の背側と腹側を比較すると、虹彩背側だけでWnt2b因子が分泌されていることがわかりました。このことが、虹彩の背側だけから水晶体が再生される原因であることを示すために、次の実験を行いました。虹彩を、背側と腹側に切り分けて別々に培養して、培養皿の中で水晶体の再生を起こさせる実験です。Wnt2bと同じ働きをするWnt3a因子を培養に加えました。すると、Fgf2とWnt3aを培養皿に加えることによって、虹彩腹側からでも、立派に水晶体が発生しました。Wnt因子が作用するか作用しないかで、水晶体再生の第2段階が起きるかどうかが決められることが示されました(図4AB)(文献7)。
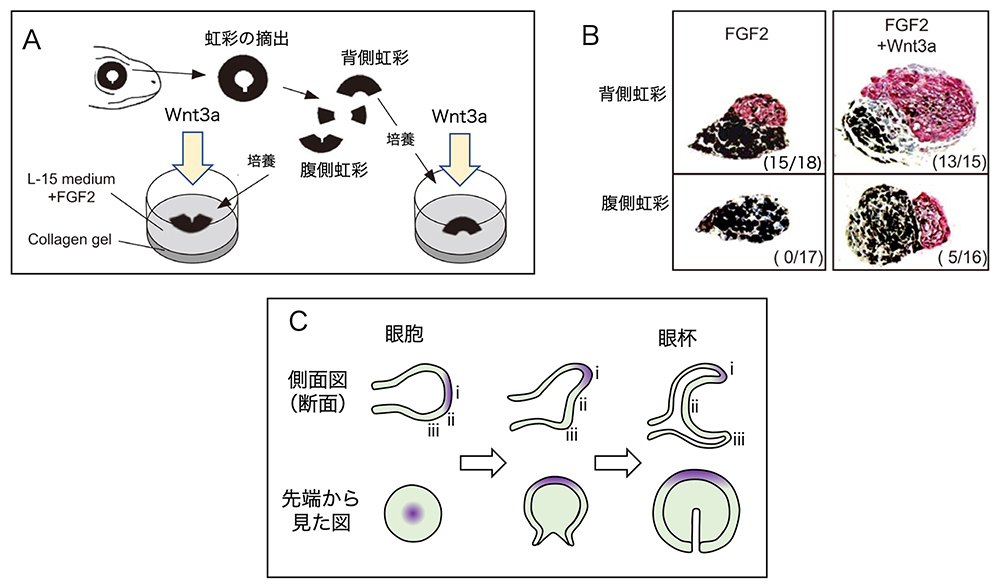
(図4) Wntシグナルの作用で進行する、再生第2段階としての水晶体の発生
A. 虹彩の背側断片、腹側断片の単離と培養の模式図。
B. Wnt3aの添加によって、虹彩腹側断片からも水晶体を再生できることを示した実験結果。水晶体は赤くそめだされている(クリスタリンの免疫染色)。
C. 網膜原基の発生過程におけるWnt2bの発現組織の位置の変化。Wnt2b発現組織は紫で示している。眼胞の段階でi, ii, iiiの位置にあった細胞群は、腹側組織の細胞増殖によって、大きく位置を変える。同時に、Wnt2b発現組織も眼杯の背側端に位置を変える。この位置の組織が、虹彩背側に発生する。
A Bは、文献7からElsevierからの許可を得て転載。
ではなぜ、虹彩の背側だけでWnt2b因子が分泌されるのでしょうか?網膜と虹彩のもとになる組織である眼杯が作られる過程に、その秘密があります(図4C)。最初、眼胞という脳から側方への出っ張りが作られるのですが、その出っ張りの先端の細胞群でWnt2bが合成され、分泌されて、出っ張りの伸び出しを促進しています。しかし、その袋状の出っ張りから、内側が凹んだ眼杯を形成する際に、眼胞の背側は増殖を遅め、腹側のみが積極的に増殖するために、Wnt2bを発現する細胞群は背側に追いやられ、最終的には、網膜背側の端に限局されます(文献8)。その場所から虹彩の背側部分は生み出されます。虹彩組織の中ではWnt2bの合成は止まっていますが、その組織が水晶体再生モードに入ると、Wnt2bの合成を再開するのです。
脳や脊髄の再生
既にVOL2で紹介した、イモリでは起きる切断した四肢の再生も、幹細胞ではなく既存の体細胞が流用されて起きる現象でした。イモリの再生能力には驚嘆させられます。そのもうひとつの例として、中枢神経系(脳・脊髄)の再生を取り上げましょう。
イモリの中脳を3分の1ほど切り除いても、数ヶ月かければ構造的にも機能的にも再生してしまいます。生体脳には、神経細胞(ニューロン)と2種類のグリア細胞(オリゴデンドログリア、アストログリア)に加えて、上衣細胞と呼ばれる第4の細胞種が存在します。上衣細胞は、脳脊髄液と脳・脊髄組織の境にびっしりと隙間なく配列された細胞で、脳脊髄液側(脳室側)に繊毛を持っています。上衣細胞は元はと言えば、胎児期に神経細胞やグリア細胞を生み出して来た(成体にはない)放射状グリアの成れの果てです。(嗅球や海馬などの、一生を通じて更新される神経細胞のための神経幹細胞も存在しますが、それらの神経幹細胞はアストログリアの一部です。)
イモリの脳の再生の元になっているのは、上衣細胞です。上衣細胞は通常ではほとんど細胞分裂することのない安定な細胞ですが、ひとたび脳が損傷を受けると増殖を開始し(活性化)、その前世であった放射状グリアと同様、神経細胞、グリア細胞を生み出して、脳を再生します(文献9〜11)(図5)。
私たち哺乳類の脳が損傷を受けると、ただアストログリア細胞が増殖して、損傷を受けた部分を埋めるだけで(グリオーシスという現象)、神経系としての脳は再生しません。その増殖グリア細胞に遺伝子操作を施してなんとか神経細胞を――わずかではあるが――生み出すことができたという報告が相次ぎ、少しの希望を与えていましたが、図5に示したような厳密な細胞追跡実験によって、アストログリアから神経細胞への変化は起きていないことが示されました(文献12)。一方、哺乳類の脳の上衣細胞は、脳の損傷に対して何の反応も示しません。哺乳類の損傷脳の再生については、全く目処が立っていないという現状です。
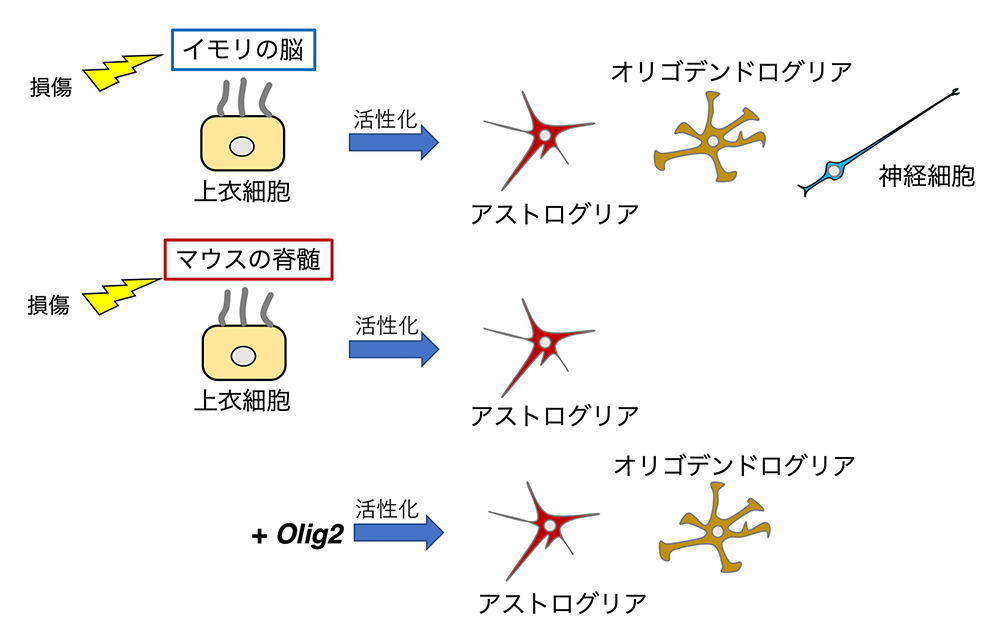
(図5) 活性化上衣細胞からの神経組織の再生
しかし、脊髄の研究から、少し光明を感じています。頭から尻の間のどこかで大きな脊髄損傷が起きると、その損傷部位よりも下半身側で運動機能・感覚機能の全てが失われるという大きな影響が出ます。この影響は、脊髄損傷の場所での神経細胞が失われたためではありません。神経細胞は長い軸索で脳と末梢(手足など)をつなぎ、軸索を流れる電気信号で、運動や感覚のシグナルを双方向に送っています。軸索はいわば電線です。その電線の間でショートが起きないように被覆の役割をしているのが、オリゴデンドログリアなのです。脊髄損傷後に、オリゴデンドログリアが再生しないために、損傷部位で電線間のショートが起きて、脳と末梢の間の電気信号が伝わらなくなるのが、「下半身麻痺」の原因です。ですから、オリゴデンドログリアをうまく再生させることができれば、「下半身麻痺」は回避できるはずです。
マウスの脊髄に損傷を与えて脊髄組織の反応を調べたフリセン(Frisén)のグループは、アストログリアが増えるグリオーシスは確かに起きるが、それに先立って、イモリの脳と同じく、上衣細胞が増殖を開始すること、その増殖した上衣細胞がアストログリアを生み出していることに気づきました。さらに詳しく調べると、分裂を開始した上衣細胞でOlig2という転写因子さえ発現してくれれば、オリゴデンドログリアを生み出すに必要な遺伝子が全て働き出して、オリゴデンドログリアが再生しそうだという予想も立ちました。
実際に、マウスの脊髄に損傷を与えると同時に上衣細胞でOlig2を強制発現する操作を行うと、アストログリアとオリゴデンドログリアの双方が上衣細胞から生み出されるとともに(図5)、下半身麻痺もかなり抑えられたのです(文献13)。
このような作業を、一歩ずつ進めることによって、損傷を受けた脳の場合でも機能を再生する道が切り開かれることを期待します。まずは、脳の上衣細胞の活性化が一つの課題かもしれません。いずれにせよ、イモリでの再生過程を明らかにすることが、哺乳類での組織再生の実現の道標になるはずです。
そもそも、イモリで実現される再生過程の多くが、なぜ哺乳類では実現できないのでしょうか?それについては少し専門的になりますが、私は次のように考えています。発生段階の途中の細胞種でも、出来上がった細胞種であっても、その細胞状態に対して邪魔な遺伝子の発現は抑制しなければなりません。代表的な抑制機構に、H3K9me3、H3K27me3という2つの異なったヒストン修飾があります。H3K9me3は遺伝子の発現抑制に加えてそのゲノム領域のヘテロクロマチン化を伴うために、遺伝子発現の再開が難しい状態を導きます(2重鍵状態)。一方、H3K27me3は、遺伝子の制御領域をユークロマチン(euchromatin)状態のまま抑制するので、遺伝子発現の再開がH3K9me3による場合よりも容易です(1重鍵状態)。脳・脊髄の再生のためには、上衣細胞を活性化(細胞増殖の再開)するとともに、上衣細胞では邪魔だった神経細胞やグリア細胞のための遺伝子を再活性化する必要があります。哺乳類では、H3K9me3が遺伝子抑制に多用されていて遺伝子の再活性化が困難であるのに対して、イモリではH3K27me3が多用されていて、容易に遺伝子の再活性化が起きるのではないか?これが私の推測です。さて、事実はどうなるでしょうか?
イモリのエース
今回述べてきたように、イモリは、再生過程を研究する上で余獣をもって代えがたい動物なのですが、大きな弱点がありました。ほとんどのイモリは、実験室の中で世代を重ねるのに数年を要し、繁殖率も高くないという点です。図2に示したような厳密な実験を行うには、数世代を要する遺伝子操作が必要なのですが、これまでのイモリではそのような実験はほとんど不可能だったのです。
最近、そのイモリの欠点を克服した「エース」が現れました(文献14)。イベリアトゲイモリ(Pleurodeles waltl)です(図6)。図6中の表に示すように、実験室の中で短期間によく繁殖するだけでなく、再生のスピードも早く、さらに最も現代的な遺伝子操作法であるゲノム編集の効率が、これまでに使われた動物種の中でも格段に高い(文献15)という利点があります。先に述べた、上衣細胞からの脳の再生も、このイモリを用いて証明されたものでした(文献11)。
なぜ「トゲ」イモリなのか?イベリアトゲイモリの肋骨に外向きの出っ張りがあって、相手を威嚇する際には肋骨を広げて出っ張り(トゲ)を皮下から出すことから来ています。
スペインのイベリアトゲイモリはIUCN Red Listで準絶滅危惧種に指定されていますが、現在研究に利用されているイベリアトゲイモリは、以前にペット化された個体群のさらなる人工繁殖によって、研究に供されているものです。この動物の研究環境での繁殖力の賜物です。

(図6)イベリアトゲイモリと、その実験動物としての特長
写真は、広島大学両生類研究センター 林利憲教授提供。表は文献14を参考に作表。
引用文献
[1] Yanger K, Zong Y, Maggs LR, Shapira SN, Maddipati R, Aiello NM, Thung SN, Wells RG, Greenbaum LE, Stanger BZ. (2013). Robust cellular reprogramming occurs spontaneously during liver regeneration.Genes Dev. 27(7):719-24. doi: 10.1101/gad.207803.112.
[2] Deng X, Zhang X, Li W, Feng RX, Li L, Yi GR, Zhang XN, Yin C, Yu HY, Zhang JP, Lu B, Hui L, Xie WF. (2018). Chronic Liver Injury Induces Conversion of Biliary Epithelial Cells into Hepatocytes. Cell Stem Cell. 23(1):114-122.e3. doi: 10.1016/j.stem.2018.05.022.
[3] Han X, Wang Y, Pu W, Huang X, Qiu L, Li Y, Yu W, Zhao H, Liu X, He L, Zhang L, Ji Y, Lu J, Lui KO, Zhou B. (2019). Lineage Tracing Reveals the Bipotency of SOX9+ Hepatocytes during Liver Regeneration. Stem Cell Reports. 12(3):624-638. doi: 10.1016/j.stemcr.2019.01.010.
[4] Colucci VL. (1981). Sulla rigenereazione parziale dell'occhio nei Tritoni-Istogenesi e sviluppo: Studio sperimentale. Mem R Acad Sci Ist Bologna. Ser 51:593-629.
[5] Wolff G. (1895). Entwicklungsphysiologische Studien. I. die Regeneration der Urodelenlinse. Wilhelm Roux Arch Entwickl-Mech Org. 1:380-390.
[6] Hayashi T, Mizuno N, Ueda Y, Okamoto M, Kondoh H. (2004). FGF2 triggers iris-derived lens regeneration in newt eye. Mech Dev. 121(6):519-26. doi: 10.1016/j.mod.2004.04.010.
[7] Hayashi T, Mizuno N, Takada R, Takada S, Kondoh H. (2006). Determinative role of Wnt signals in dorsal iris-derived lens regeneration in newt eye. Mech Dev. 123(11):793-800. doi: 10.1016/j.mod.2006.08.009.
[8] Kondoh, H. (2002). Development of the Eye. In Mouse Development (Rossant J, Tam PPL, eds), Chapter 21, pp.519-538. Academic Press, Sand Diego and London. ISBN: 0-12-597951-7.
[9] Okamoto M, Ohsawa H, Hayashi T, Owaribe K, Tsonis PA. (2007). Regeneration of retinotectal projections after optic tectum removal in adult newts. Mol Vis. 13:2112-8.
[10] Berg DA, Kirkham M, Beljajeva A, Knapp D, Habermann B, Ryge J, Tanaka EM, Simon A. (2010). Efficient regeneration by activation of neurogenesis in homeostatically quiescent regions of the adult vertebrate brain. Development. 137(24):4127-34. doi: 10.1242/dev.055541.
[11] Urata Y, Yamashita W, Inoue T, Agata K. (2018). Spatio-temporal neural stem cell behavior leads to both perfect and imperfect structural brain regeneration in adult newts. Biol Open. 7(6):bio033142. doi: 10.1242/bio.033142.
[12] Wang LL, Serrano C, Zhong X, Ma S, Zou Y, Zhang CL. (2021). Revisiting astrocyte to neuron conversion with lineage tracing in vivo. Cell. 184(21):5465-5481.e16. doi: 10.1016/j.cell.2021.09.005.
[13] Llorens-Bobadilla E, Chell JM, Le Merre P, Wu Y, Zamboni M, Bergenstråhle J, Stenudd M, Sopova E, Lundeberg J, Shupliakov O, Carlén M, Frisén J. (2020). A latent lineage potential in resident neural stem cells enables spinal cord repair. Science. 370(6512):eabb8795. doi: 10.1126/science.abb8795.
[14] Hayashi T, Yokotani N, Tane S, Matsumoto A, Myouga A, Okamoto M, Takeuchi T. (2013). Molecular genetic system for regenerative studies using newts. Dev Growth Differ. 55(2):229-36. doi: 10.1111/dgd.12019.
[15] Takeuchi T, Matsubara H, Minamitani F, Satoh Y, Tozawa S, Moriyama T, Maruyama K, Suzuki KT, Shigenobu S, Inoue T, Tamura K, Agata K, Hayashi T. (2022). Newt Hoxa13 has an essential and predominant role in digit formation during development and regeneration. Development. 149(5):dev200282. doi: 10.1242/dev.200282.
バックナンバー
VOL.4 胚のいつ、どこで、何を発生させるのかには欠かせない抑制機構
VOL.8 動物の形の多様性という名の変奏曲集I 目と顔と手
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)