VOL.7 培養皿の中の幹細胞は、発生の「時」を止めている
近藤寿人(JT生命誌研究館 顧問・表現ディレクター)
「多能性幹細胞を用いた…」といった表現を目にする機会が増えてきました。iPS細胞を作れる!という高橋―山中の研究[文献1]は、「多能性幹細胞」の未来を大きく広げました。しかし「多能性幹細胞」が何であるかを語らずに議論を展開している記事も少なくありません。
「多能性幹細胞」とは、体を構成するあらゆる細胞に「発生」する能力と、培養皿の中で増え続ける能力とを合わせもつ細胞を指します。しかし、このような細胞は体の中に維持されているわけではありません。「多能性幹細胞」は、培養皿の中で維持されている人工的な状態なのです。「多能性幹細胞」にはさまざまなものがあって、いずれも胚の中ではすぐに通り過ぎてしまう発生の1段階―――このような一瞬の「細胞の発生の時」を止めて培養皿の中で増やしたものが、ES細胞などの人工多能性幹細胞です。発生を止める時期の違いによって、さまざまな「培養皿の中の幹細胞」が作られてきました。「多能性幹細胞」を作り出した、多くの研究者の試行錯誤(研究の現場)についても触れながら、細胞の発生の時を止めるお話をします。
ES細胞前夜
「多能性幹細胞」の時代を開いたのは、Martin G Evansによる、マウスの胚性幹細胞(Embryonic stem cell)= ES細胞 [文献2]の培養ですが、ローマは1日にしてならず。それに先立つ時代から話を始めます。
卵巣や精巣に、毛髪や脂肪組織を代表とした体細胞組織の塊でできた「奇形腫(teratoma)」という良性腫瘍ができることがあります。これは、生殖細胞が単為発生を起こして体細胞を生み出したものと考えられていますが、奇形腫の一部は、その中に増え続ける悪性の細胞を持つものがあって「奇形癌腫(teratocarcinoma, embryonal carcinoma, EC)」として区別されます。マウスの着床直後の胚を、精巣や腎臓の皮膜下(血管を介した栄養供給が豊富であるとともに、宿主からの免疫的な攻撃が少ない)に移植することによっても奇形癌腫を作ることができるので、奇形癌腫は、子宮外環境で発生を始めてしまった胚組織の一部から生まれるものと考えられました[文献3,4]。奇形癌腫細胞を培養すると、その条件によって、ただ増え続ける奇形癌腫の状態を保つこともできるし、体細胞に分化させて奇形腫の姿に変えることもできるとわかってきました。
一方、Ralph Brinsterは、マウスの着床前胚である胚盤胞の中空部である胞胚腔に、さまざまな培養癌細胞を注入して、胚発生への影響を調べていました。ほとんどの場合、癌細胞は生着しなかったのですが、白マウスの胚盤胞に黒マウス由来の奇形癌腫の培養細胞を注入し、母マウスの子宮に着床させると、皮膚の一部に、奇形癌腫の由来であることを示す黒い皮毛を持つマウスが生まれました。これが、奇形癌腫細胞を用いたキメラマウスの第1号でした[文献5]。(異なった親由来の体細胞を持つマウス個体をキメラマウスという)。Beatrice Mintzは、当時の最先端技術であるイソ酵素解析を用いて、奇形癌腫細胞由来細胞がキメラマウスのほとんどの組織に正常組織として参加していることを示しました[文献6]。これらのキメラマウスは、癌を発症することがなく、当時は「正常発生に参加させることによって、癌が治った」ともてはやされました。「正常発生に参加できなかった初期胚細胞が奇形癌腫という癌状態をとる」というのが、より正確な表現です。Ralph Brinsterは、マウス胚培養技術を改善し、さらにトランスジェニックマウスを初めて作成するなど[文献7]、マウス胚を用いた現代的な研究方法の確立に欠け難い貢献をしました。
マウス胚盤胞を精巣などに移植すると奇形癌腫ができること、また、培養皿の中で増やされた奇形癌腫を胚盤胞内に戻すと(おそらく胚盤胞の内部細胞塊に取り込まれて)正常発生に高率で参加することから、「うまくやれば、胚盤胞の内部細胞塊を直接培養することによって、奇形癌腫よりももっと正常な内部細胞塊に近い細胞株を得ることができるはずだ!」という確信が研究分野の中に生まれ、多くの研究者がそれに取り組みました。しかし、多くの研究者たちの10年ほどの期間の努力はほとんど成果に結びつきませんでした。
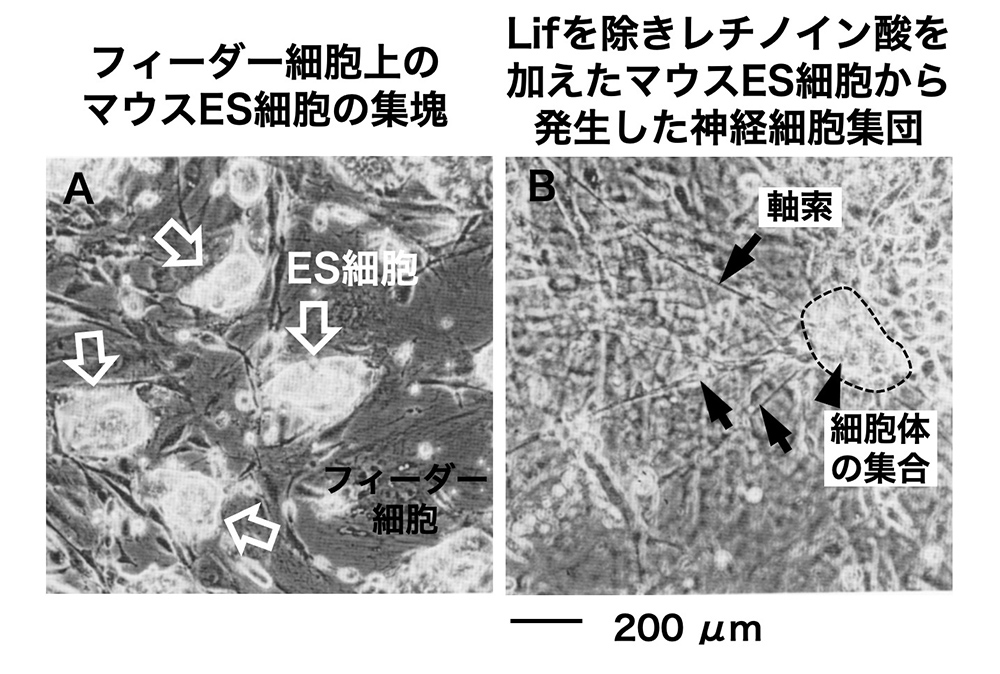
(図1)
A. フィーダー細胞とともに培養されたマウスES細胞の胃操作顕微鏡像。数十個のES細胞の集塊が白く光って見える(白矢印)。他はマイトマイシンC処理で増殖を止めたフィーダー細胞。
B. その培養からLifを除くと、ハイポブラスト、(エピブラスト段階を経た)体細胞への発生が始まる。その際にレチノイン酸を加えると、体細胞への発生が促進される。そのような培養の中で見られる神経細胞集団。文献14より。
マウスES細胞の誕生
1981年に、Martin J Evansは、協力者MH Kaufman(発生休止(diapause)などマウス胚発生についての詳しい情報を与えた)と共著で奇形癌腫と似た細胞株EK(現在のES)細胞を、胚盤胞から直接樹立したという論文を発表しました[文献2]。ES細胞株樹立の成功の鍵は、STOという線維芽細胞と共培養したことです[コラム1]。その後、このSTO細胞から分泌される因子がLif (Myeloid leukaemia inhibitory factor)と呼ばれる分泌タンパク質であることが明らかになりました[文献8]。この因子の同定のおかげで、ES細胞を安定に維持するためのさまざまな培養液が開発されましたが、どの培養液も、必ずLifを含んでいます。そしてLifを使った培養液を用いて樹立されたES細胞株はいずれも着床前の胚の内部細胞塊に近い性質を持っていました(図1)。ES細胞をマウスの腹腔などに移植すると奇形腫が形成されます。これは、これから述べる多能性幹細胞のいずれにも共通した性質です(図2)。
LifはES細胞株の樹立と安定な増殖を支え、多様な活性を持つLifですが[コラム2]、次に述べるノックアウトマウスの方法でLif遺伝子を破壊したマウス胚は正常に発生して大人になります。ただ、母親の子宮がLifを持たないと胚が着床できないので、子宮上皮の発達にはLifが必要であることがわかりました[文献9]。
つまり、ES細胞に必要なLifは本来の胚盤胞の発生には全く関わっておらず、ES細胞に対するLifの作用は、極めて人工的な作用なのです。後にも述べるように、マウス胚の中で起きる内部細胞塊の発生過程を無理やりに止めてES細胞として増殖させる作用を、Lifがたまたま持っていたということに過ぎません。
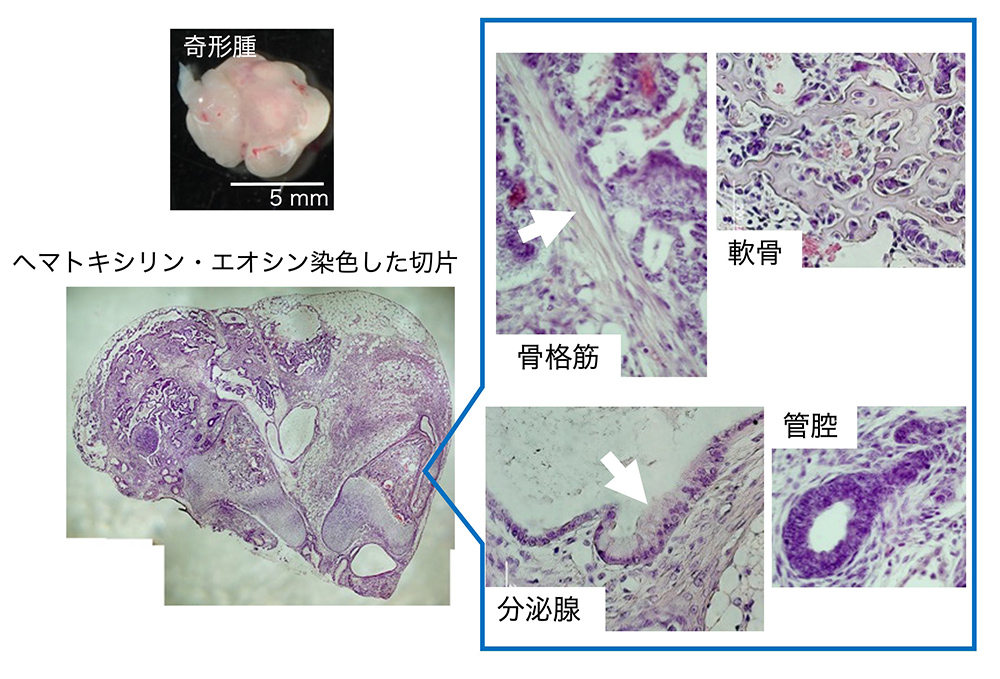
(図2)「多能性幹細胞」を免疫不全マウス(移植細胞に対する拒否反応を起こさない)に移植した場合に生ずる奇形腫(teratoma)の例。
この奇形腫は、後半で述べる、エピブラスト幹細胞i22株[文献23]を移植してできたもの。稲森祥子原図。
コラム1 フィーダー細胞
いろいろな細胞株は、フィーダー(feeder)細胞(マイトマイシンC処理などでDNA合成を起こさなくなったが、細胞としては生きていてさまざまな活性物質を出す細胞)と一緒に培養皿の中で培養すると、フィーダー細胞が出す物質の効果によって安定に培養できることが少なくありません。Evansはさまざまな細胞のフィーダー細胞としての活性を試していて、STO細胞に、「内部細胞塊から派生する奇形癌腫状態の細胞を、その状態を維持しながら増殖させる」フィーダー細胞としての活性を見つけたのでした。
コラム2 Lifの活性
今日ではLifという通称名で呼ばれる因子は、急性骨髄性白血病の細胞の培養皿の中での増殖を抑制したり分化させたりする効果を持つ分泌タンパク質として見つけられたものですが、強い制御活性を持つことから、さまざまな研究で独立して見つけられていました。例えば日本では、市川康夫氏がM1というマウスの骨髄性白血病株をマクロファージに分化させる因子として見つけ、D-factorと名付けていました[文献10]。また交感神経にアセチルコリン作動性を与える因子がLifと同一であることを山森哲夫氏が示す[文献11]など、多岐にわたる生理現象の制御因子であることがわかっていたのです。
ES細胞はキメラマウスの中で生殖細胞にもなる:ノックアウトマウスの時代の到来
ES細胞は胚盤胞に注入すると宿主胚の内部細胞塊に合流してキメラマウスを作り、そして1個体の中でES由来細胞はさまざまな組織に分布します。その一つは生殖細胞です。ですから、XYの性染色体を持つES細胞由来細胞が、雄の性質を持つキメラ個体の中で生殖細胞に分布すると精子となり、その精子を介してES細胞のゲノムの半数体分が次の世代に伝わります[文献12]。これをgermline transmission(生殖系列伝達)と呼び、当初は良質のES細胞株であることの証明書のように使われました。良質のES細胞株からは、培養条件を操作することによってさまざまな体細胞を発生させることができ、現在研究手段として発展している「オルガノイド(organoid, 擬器官)」も当時から展望されていました(図3)。
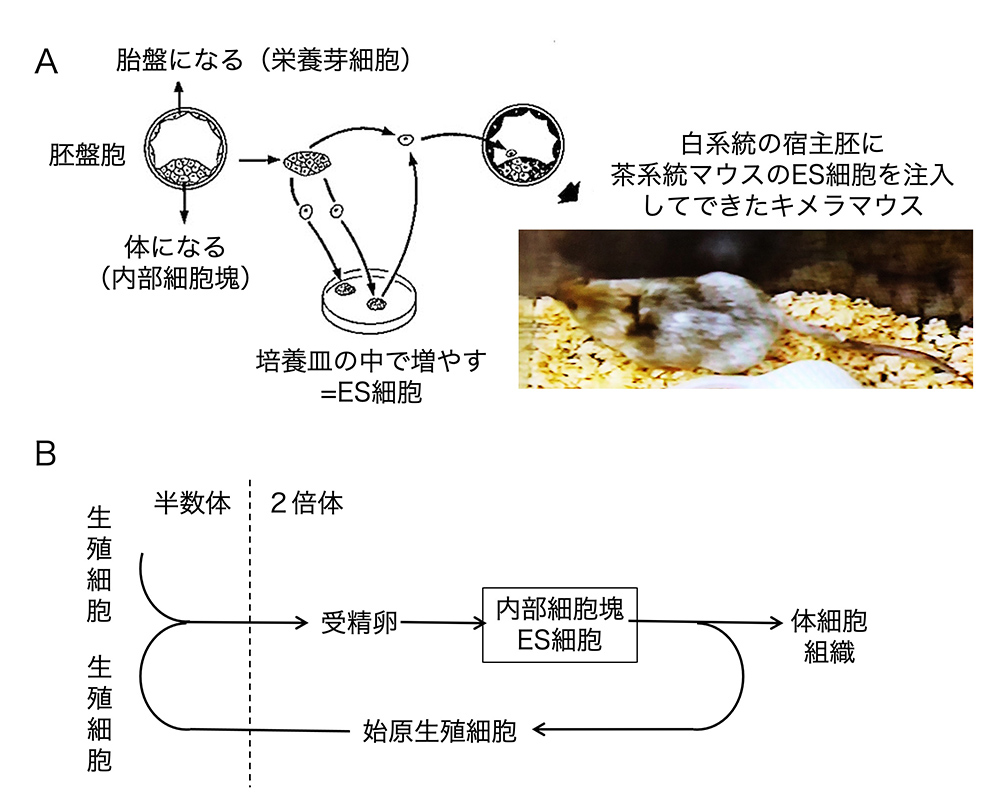
(図3)ES細胞とキメラマウス。1990年代に筆者が解説用に使っていた図の復元。(A) ES細胞の胚盤胞への注入によるキメラマウス作製の原理。(B)キメラマウスの中でES細胞に由来するゲノム情報が、配偶子形成を経て子孫に伝わる原理。
しかしES細胞の効能はそれにとどまりません。ES細胞ゲノム情報が次世代に伝わることが、ノックアウトマウスの時代を拓きました。Mario R Capecchiは、ES細胞の中で導入DNAと相同組換えを起こさせる技術を開発し、それを用いてES細胞の中の特定の遺伝子のDNA配列を破壊すること、そしてそのES細胞での遺伝子操作の結果を、キメラマウス作製のステップを経て子孫に伝えることに成功しました。1988年に報告された最初の遺伝子操作(遺伝子破壊=ノックアウト)マウスはInt-2(現在のFgf3)遺伝子に関するものでした[文献13]。ちなみに、日本での最初のノックアウトマウスは私たち[文献14]と相賀-相沢グループによるもの[文献15]で、1991年から1992年にかけて論文発表されました。
Capecchiの報告から30年間、「ES細胞で遺伝子破壊操作(変異導入)を行ったのちにキメラマウスを経て子孫個体にその変異を伝える」ことはノックアウトマウス(ある狙った遺伝子に変異を持ったマウス)作製方法の定番となり、生命科学に莫大な貢献をしました。欠点といえば、のちにも論ずるように、この方法はマウスにしか使えないことです。最近急速に技術が進歩した「ゲノム編集」の技術は対象となる生物種の枠の多くを取り払い、ノックアウトマウスの作製方法の主流もゲノム編集に移行しつつあります。
話は遡って、ES細胞でgermline transmissionが起きるのなら、そのプロトタイプである奇形癌腫細胞株でも可能ではないか?という疑問は当然です。しかし、奇形癌腫を使ったキメラマウスの組織での癌腫細胞由来細胞が占める割合は、ES細胞を使った場合に比べて遥かに低く、生殖細胞となって次世代にそのゲノム情報が伝わることはありません。マウス奇形癌腫細胞株の染色体を調べると、大規模な染色体異常(染色体の断片化、融合、数の増加、減少)が起きていました。良性の奇形種に発生せずに奇形癌腫として止まった時点ですでに染色体異常が生じていた可能性もあります。
Lifは他の哺乳類の胚には効かない:ヒトのES細胞とは?
マウスでES細胞が樹立され、それにLifが有効であることがわかるとすぐに、他の動物種でもES細胞を樹立しようという試みが始まりました。特に、直接に着床後胚を研究することができないヒトについては、ES細胞の樹立が切望されました。培養された着床前ヒト胚からES細胞株を樹立すれば、ES細胞から出発したオルガノイドを作り分析することによって、ヒトの諸器官の初期発生や細胞の性質について、多くの情報が得られると期待されたからです。畜産の分野ではノックアウトマウスに似た手法で、家畜の品種改良ができるのではないかという期待がありました。
しかし、Lifの効果で内部細胞塊から次の発生段階(エピブラスト)への発生を止めて、ES細胞として増殖させることができたのは、マウスと近縁のラットだけでした。Lifは、他の哺乳類胚には、全く無効でした。
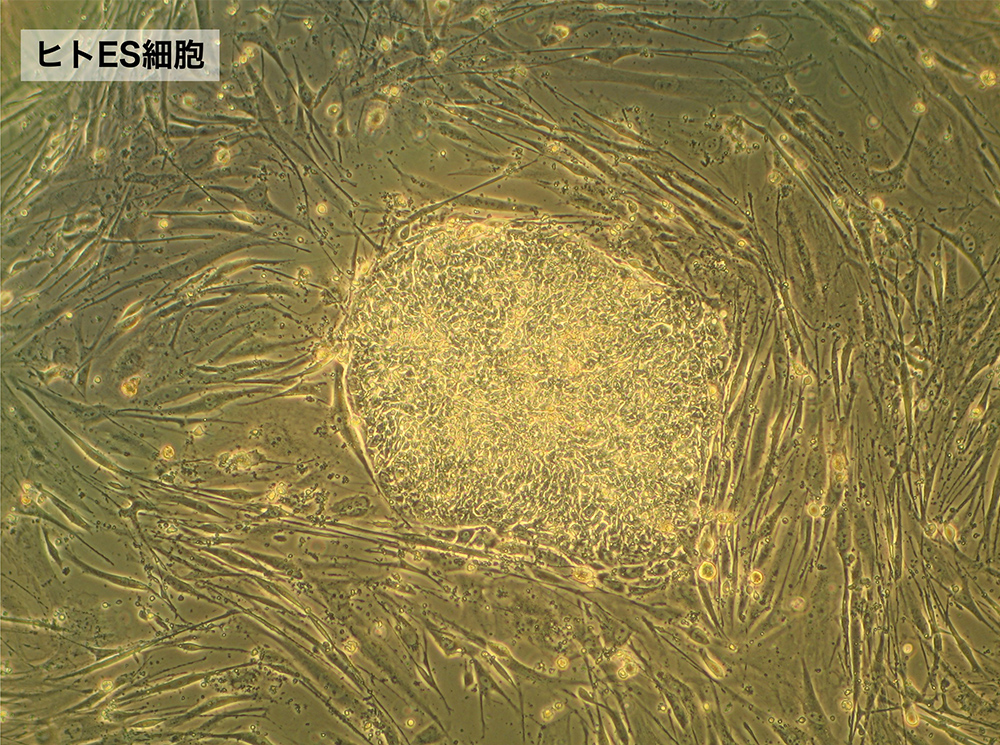
(図4)フィーダー細胞上で増殖したH9 ヒトES細胞のコロニー(集塊)。マウスのES細胞とは違って、平板状の細胞集塊を作る。
データ:Public Domain. 出典:Ryddragyn at English Wikipedia。
1998年になってやっと、James Thompsonらによって「ヒト胚盤胞を培養して樹立したES細胞」という論文が発表されました[文献16](図4)。確かに、胚盤胞から出発した培養で樹立され、マウス初期胚(着床前とは限らない)に固有の表面抗原を持っていること、免疫不全マウスへの移植によって奇形腫を形成することなど、マウスのES細胞と似ているようには見えたのですが、実は、マウスのES細胞とは重要な点で異なるものだということが徐々に明らかになってきました。同様のヒト「ES」細胞がアクチビンとFgf2という2つの分泌タンパク質を含む培養液で、フィーダー線維芽細胞を用いると、比較的再現性よく樹立できることもわかりましたが、いずれの場合も、着床前胚(Fgf4を合成する)の培養から出発したにもかかわらず、樹立される細胞株は着床後胚のエピブラストに近い性質(Fgf5を合成する)を示したのです。これらのヒトの細胞株を、マウスのES細胞とは重要な性質が異なるにもかかわらず「ES」細胞と呼んでしまったことが誤謬を生んだ面もあるのですが、本論ではそれらを区別しながら話を続けましょう。(図5)
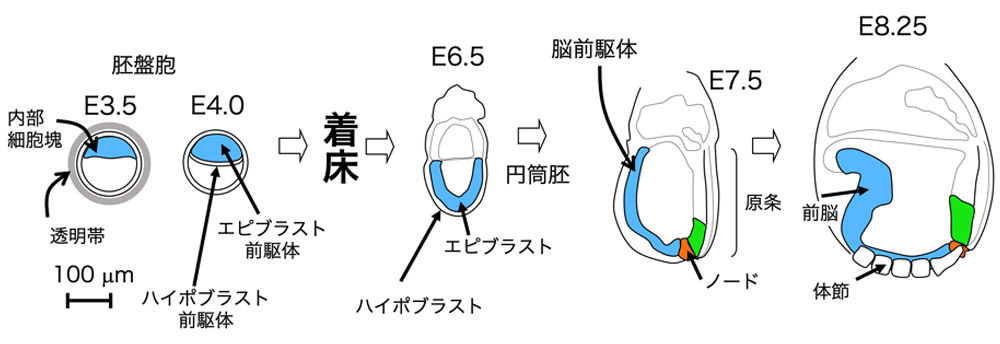
(図5)マウス胚を例とした、着床前、着床後の発生の比較。Eの後の数字は、受精後の日数を示す。
マウスのエピブラスト幹細胞
ヒトのES細胞が、着床後胚のエピブラストの性質を持つのであれば、その培養条件(アクチビンとFgf2を含んだ培地)で、着床後のマウス胚のエピブラストを培養すれば、マウスのエピブラストの幹細胞株を樹立できるのではないか?そのように考えた2グループの目論見は的中して、エピブラストの性質を持ったマウス エピブラスト幹細胞株が樹立されました[文献17,18]。エピブラスト幹細胞株も、マウスES細胞、ヒトES細胞と同様、免疫不全マウスへの移植によって奇形腫を生み出すなど、「多能性幹細胞」としての資格を十分に持っています(図2、図6)
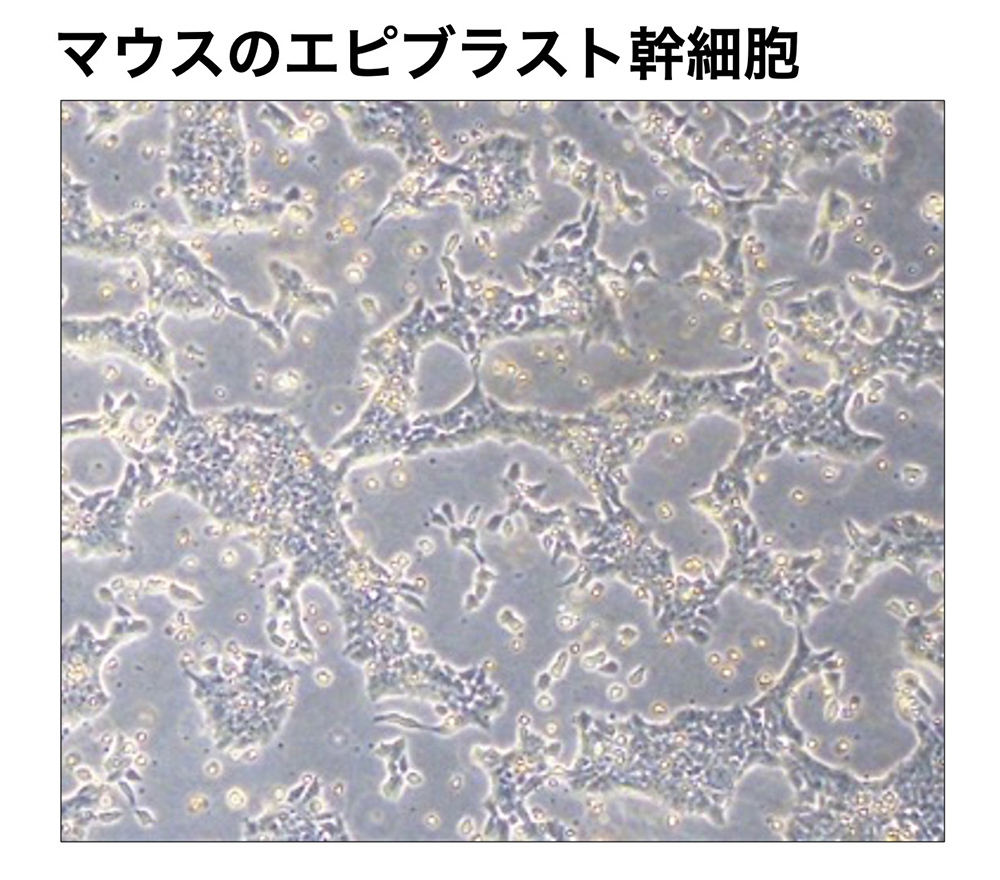
(図6)エピブラスト細胞株i22の培養 [文献23]。フィーダー細胞は使っていない。ヒトES細胞と同様に、平板な細胞の集塊を作る。
私たちは、Sox2, Pou5f1(=Oct3=Oct4)といった、「多能性幹細胞」に共通して発現される転写因子(図7)が、それぞれの幹細胞状態でどのような遺伝子を調節しているのかを比較する研究を行いました[文献19]。
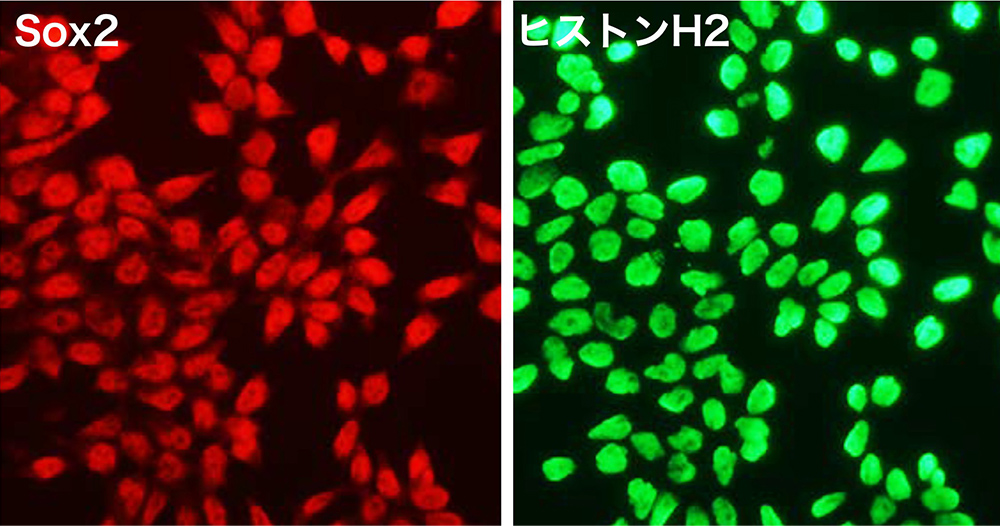
(図7)エピブラスト幹細胞でのSox2の発現を抗体蛍光染色(赤)で示した。同視野のヒストンH2の蛍光染色(核染色)との比較でわかるように、Sox2のほとんどは核に分布している。エピブラスト幹細胞(本図)を含めて、「多能性幹細胞」は、転写因子Sox2, Pou5f1を発現するが、発生段階ごとに、それらの転写因子が制御する遺伝子は異なっている [文献19]。
すると、これらの転写因子は、マウスのES細胞とマウスのエピブラスト幹細胞の間で、90%以上は異なった遺伝子を調節していること、ヒトのES細胞では、マウスのES細胞と同じ遺伝子を調節しているケースと、マウスのエピブラスト幹細胞と同じ遺伝子を調節している場合とが混在していることがわかりました。それらの関係を図で示すと、図8のようになります。ヒトのES細胞は、発生段階で言えば着床直後の段階、細胞状態で言えば、マウスのES細胞からマウスのエピブラスト幹細胞への移行の中間状態に対応しています。そしてこれらの状態はいずれも、胚発生の途上で安定に存在するものではなく通過するものーーつまり、培養皿の中の幹細胞は発生の「時」を止めて増やされたものなのです。
(図8)3つの異なった「多能性幹細胞」の由来と発生段階の比較。
しかし、自在に発生の「時」を止めることができているわけではありません。着床前の胚盤胞期の胚をLifの存在下で培養すると必ずほとんど同じ性質を持ったES細胞株が得られます。また、ES細胞株をエピブラスト細胞株の培養条件に移すと、ES細胞が着床後のエピブラストの発生と同様な変化を起こして、(ヒトES細胞の発生段階では止まらずに)、胚のエピブラストを培養したときに得られるものと同じ性質を持ったエピブラスト幹細胞が得られることもわかりました[文献20]。マウス胚の発止の進行は、培養皿の中では、着床後の内部細胞塊の状態と、着床後の成熟したエピブラストの状態という2つのタイミングでのみ「時」を止めることができる。一方、ヒトの胚から出発した場合には着床前の状態で発生を止めることはできず、着床後の早期で初めて「時」を止めることができる、という動物種間での違いがあるのです。
iPS細胞を作る遺伝子操作(Sox2,Pou5f1,Klf4,Mycをまず強制発現して、それらの内在の遺伝子の発現を促す)は、マウスの場合でもヒトの場合でも基本的には同じなのですが、結果はマウスとヒトで異なります。マウスの場合にはLif依存性のマウスES細胞とそっくりのものができるし[文献1]、ヒトの場合はアクチビン+Fgf2で維持される、ヒトES細胞によく似たものができる(強制発現遺伝子は、着床前胚で発現されるセットであるにもかかわらず)[文献21]ことから、マウス胚とヒト胚ではやはり「時」を止めるタイミングが異なることが確かめられます。
「多能性幹細胞」の使い分け
発生段階が異なる「多能性幹細胞」はどのように使い分けられるのでしょうか?よく考えると「多能性」という立派そうに聞こえる呼び名は、要するにさまざまな「体細胞系列に分かれる前」の幹細胞という事になります。
体細胞の発生の機構を研究するのであれば、その一歩手前のエピブラスト幹細胞を用いるのが最適でしょう。私たちも、エピブラスト幹細胞を用いて、神経系が誕生する初期過程についての研究[文献22]、内胚葉の発生を誘起するエピブラストと基底膜の相互作用[文献23] などの研究を進めてきました。マウスES細胞から出発した神経系の初期発生の研究もこれまでに盛んに行われてきました。その際には概ね2段階の細胞培養が行われます。マウスのES細胞を細胞集塊(aggregate)として培養すると、内部細胞塊が、エピブラストとハイポブラスト(始原内胚葉)に発生するのと同様に)発生したエピブラストを内側に、ハイポブラストを外側にもつ「胚葉体(embryoid body)」ができます。この第1段階の培養の後、内側のエピブラスト層を取り出して、神経系の発生に向かわせる第2段階の培養を行います(図9)。第1段階の培養はエピブラストを取り出すためだけの培養ですから、そういう事ならエピブラスト幹細胞を最初から利用するのが勝ります。
一方で、エピブラストとハイポブラストの直接的な相互作用のもとに起こるであろう発生過程の研究にはES細胞から発生した「胚葉体」が必然性を持つでしょう。また、生殖系列の発生の研究には、生殖系列とエピブラストが分かれる前の段階の幹細胞であるES細胞を用いる必要があります(図3)。
このように、何を研究するのかという目的に従って、どの多能性幹細胞を用いるのかを選択します。次に述べるように、「多能幹細胞」の種類は、最近増えてきているのです。
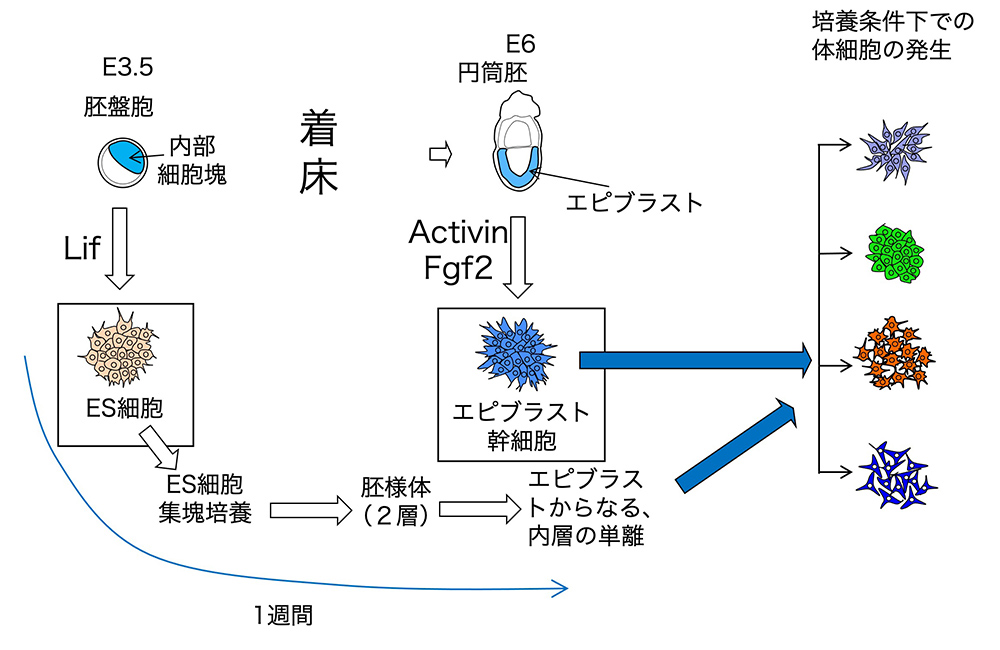
(図9)マウスES細胞と、エピブラスト幹細胞を出発素材として、体細胞の発生を調べる実験の比較。
コラム3 低分子合成化合物阻害剤で、強制的に発生の時を止める
発生の「時」を止めて増殖させて幹細胞株を得ることができるが、その「時」を止められるタイミングは、細胞に依存していて、ヒトとマウスでも異なるのだとお話ししてきました。これは、Lif、アクチビン、Fgf2といった、生体内に存在する生理的な分泌タンパク質や因子を、強制的に培養細胞に作用させた場合の話です。いわば、細胞に備わった沢山の制御回路を、壁につけられた電源スイッチのON/OFFでの調節に例えられそうな培養操作です。スイッチの奥に伸びる回線の細部を制御するわけではありません。
細胞内の様々なシグナル経路を構成する制御タンパク質に直接作用して、各々の制御機能(タンパク質のリン酸化など)を特異性高く阻害する低分子化合物が沢山開発されてきました(低分子阻害剤)。これらを細胞の培養液に添加する事によって、細胞内の複雑に絡み合った制御回路の一点の反応を停止させることができます。
また、無血清培地を用いた培養技術も発展してきました。これまでの、牛胎児血清を用いた培養は、「ある細胞の増殖や分化にどのような因子が必要かわからない状態では、とにかく色々な因子を潤沢に含んだ牛胎児血清を使いましょう」という発想です。無血清培地は、ITS(インシュリン=グルコースの細胞への輸送に必要、トランスフェリン=鉄の細胞への輸送に必要、セレナイト=亜セレン酸=多くの重要な酵素反応の補酵素)、そして多くの脂質成分が基本成分になっています。
Austin Smithのグループは、無血清培地にLifとともにCHIR99021 (GSK3βを抑制し、結果として高いWntシグナルを負荷したのと同様の効果), PD0325901(Fgfシグナル等の抑制)の2つの阻害剤を組み合わせた”2iLif”培地を開発して、それを用いれば、ES細胞を安定に培養できることを示しました[文献24]。これによって、ES細胞の良好な培養を続ける上での名人芸的な要素が少なくなりました。また、Lif, CHIR99021とCGP77675 (CRKチロシンリン酸化酵素)の組み合わせ(a2iLif)でも安定なES細胞を安定に維持できることが明らかになり[文献25]、ES細胞の中でのシグナル回路の(必ずしも特定ではない)いくつかの場所でうまく阻害してやると、ES細胞状態で発生の「時」の停止が、安定に実行されることが明らかになりました[文献25]。
この発想を発展させると、低分子合成化合物阻害剤(低分子阻害剤)を活用すれば、ヒトの細胞の場合でも、マウス胚の場合と同様に着床前の内部細胞塊状態の幹細胞株を樹立できるかもしれない。その発想で、いくつかの研究グループがヒトの着床前細胞株を樹立したのですが、沢山の低分子阻害剤が用いられており、また以下に示す2つのグループ間で低分子阻害材の組み合わせは大きく異なっていました。ちなみに、2例の培養液の組成を比べてみましょう。
1. NHSM 培地 [文献26]: Lif、Tgfβ1、 Fgf2 (以上分泌タンパク質), PD0325901 (ERK阻害)、 CHIR99021 (GSK3β 阻害)、SP600125 (JNK阻害)、 SB203580 (p38阻害)、Y-27632 (ROCK阻害), Go6983 (PKC阻害)。
2. 5i/L/A 培地 [文献27]: Lif, Activin (以上分泌タンパク質), PD0325901 (ERK1/2阻害)、IM-12 (GSK3β 阻害)、iSB590885 (B-RAF阻害)、WH-4-023 (SRC阻害)、 Y-27632 (ROCK阻害) 。
共通成分もあるものの、随分違います。例えて言えば、ヒトの内部細胞塊由来の細胞のたくさんのシグナル経路のその何箇所をも、がんじがらめに止めてやっと、幹細胞状態でしかも着床前の状態に、強引に留めているように見えます。しかし、発生の「時」を止める効果は大きく、ヒトの着床前の胚細胞に関する詳細な解析を可能にしています。
視野を広げると
本稿は「培養皿の中の幹細胞」と銘打ちながら、「多能性幹細胞」に終始しました。発生段階に応じた人工的な「培養皿の中の幹細胞」が細胞株として樹立されること、それも一筋縄ではいかないことを、皆さんにお伝えしたかったのです。
「培養皿の中の幹細胞」に、神経系幹細胞株という重要なものもあります。こちらは、さまざまの発生段階や、脳領域ごとの細胞株を、無血清培地+Egf+Fgf2といった一般的な神経幹細胞用の培地で作ることができます。神経系幹細胞株については、また機会を改めてお話しできればと思います。
[補足:生体内で分泌される因子とその略語について]
生体内で分泌されて作用する分泌タンパク質の多くは、(1)その活性が見つけられた研究で使われた細胞への作用をもとに命名されることが多く、その名前が実際の広範な活性を表現していないこと, (2)培養細胞への効果が人工的なもので、生体内での作用を反映しないことが多いこと。これらのことから、略号で語られることが多く、本稿もそれに従いました。Lif(leukemia inhibiory factor、白血病抑制因子)について紙面を割いて説明したのも、これらの2点をお伝えしたかったのです。ここであらためて、それぞれの因子について説明しましょう。
アクチビン(activin): 卵巣に働きかけて卵胞刺激ホルモン(FSH)の合成・分泌を活性化(activate)する因子として見つけられました。「Tgfβスーパーファミリー」に属する分泌タンパク質で体内に広く分布し、その作用はFSHに関するものにとどまりません。しかし、「多能幹細胞」の培養にもアクチビンが用いられることが多いのですが、それは胚発生期にエピブラストに対して作用する「ノーダル(Nodal)」と同じ受容体を使ってアクチビンが細胞内にシグナルを送ることから、Nodalの人工的な代用品として用いられているのです(アクチビンは熱にも安定で、試薬としては作りやすい)。胚発生期にアクチビンが作用しているわけではありません。アクチビンはまた、ES細胞から出発した培養の中で「中胚葉系」という組織を発生させるときにも用いられます(しばしば、非生理的な高濃度で)。これもまた、Lifと同じような人工的な作用であったり、ノーダルの代替の場合と同様に、他の「Tgfβスーパーファミリー」因子の代替として作用したりしていて、胚発生の過程で同様に働いているわけではありません。
Fgf (fibroblast growth factor; 繊維芽細胞増殖因子): この因子群には20種類以上あって、分泌されずに働くものもあります。分泌されるFgfは数種類のFgf受容体のどれか(複数)に結合し、その受容体を経て細胞内に伝えられるシグナル伝達経路の一つはERKを介したものです。その意味ではFgfシグナルには一般性もあるのですが、一方でそれぞれのFgfに固有のシグナル活性も際立っています。例えば、Vol5の再生のテーマで取り上げた「イモリの水晶体の再生」では、Fgf2が再生を開始させる因子であり、他のFgfにはその作用はありません。文献27でFgf2とERK阻害剤を併用しているのも、Fgf2に固有のシグナル活性を生かしているのだと理解されます。
Egf (Epidermal growth factor; 表皮細胞増殖因子): 分泌タンパク質が、特異性を持った制御活性(細胞増殖など)を持つことが示された最初の例で、神経増殖因子(NGF)とともに、1986年のノーベル医学生理学賞の対象となりました(Stanley Cohen, Rita Levi-Montalcini)。Egfにも広い制御活性があります。Fgfの場合と同様、受容体の下流のシグナルの一つはERKを介するのですが、EgfとFgfの作用は全体としては大きく異なっています。
レチノイン酸 (正確には、all-trans-retinoic acid): ビタミンAの代謝によって作られる、強力な(低濃度で効果を発揮する)低分子量のシグナル因子です。培養細胞への効果の多くは人工的なものです。ES細胞や奇形癌腫細胞にレチノイン酸を作用させると神経細胞を発生させることができます(例:図1)。これも、人工的な作用とみなされます。レチノイン酸が低濃度で効果を持つ、次のような実例があります。レチノイン酸を含むクリームは、ニキビの跡を綺麗に治すので一時期販売され、若い女性に歓迎されました。しかし、クリームの中のレチノイン酸は皮膚に留まらずに血流を介して体内に広がります。妊娠中の女性がそのクリームを使用すると、そのレチノイン酸はさらに胎盤を通って胎児にも影響を及ぼし、胎児に水頭症などを引き起こしました。このことから日本では販売が禁止されました。まだ販売を続けている国もあるようです。ゆめゆめ、そのようなものをお使いになりませんように。
引用文献
[1] Takahashi K, Yamanaka S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126:663-676. doi: 10.1016/j.cell.2006.07.024.
[2] Evans MJ, Kaufman MH. (1981). Establishment in culture of pluripotential cells from mouse embryos. Nature. 292:154-156. doi: 10.1038/292154a0.
[3] Stevens LC. (1970). The development of transplantable teratocarcinomas from intratesticular grafts of pre- and postimplantation mouse embryos. Dev Biol. 21:364-382. doi: 10.1016/0012-1606(70)90130-2.
[4] Solter D, Skreb N, Damjanov I. (1970). Extrauterine growth of mouse egg-cylinders results in malignant teratoma. Nature. 227:503-504. doi: 10.1038/227503a0.
[5] Brinster RL. (1974) The effect of cells transferred into the mouse blastocyst on subsequent development. J Exp Med. 140:1049-1056. doi: 10.1084/jem.140.4.1049.
[6] Mintz B, Illmensee K. (1975). Normal genetically mosaic mice produced from malignant teratocarcinoma cells. Proc Natl Acad Sci USA. 72:3585-3589. doi: 10.1073/pnas.72.9.3585.
[7] Palmiter RD, Chen HY, Brinster RL. (1982). Differential regulation of metallothionein-thymidine kinase fusion genes in transgenic mice and their offspring. Cell. 29:701-10. doi: 10.1016/0092-8674(82)90186-6.
[8] Williams RL, Hilton DJ, Pease S, Willson TA, Stewart CL, Gearing DP, Wagner EF, Metcalf D, Nicola NA, Gough NM. (1988). Myeloid leukaemia inhibitory factor maintains the developmental potential of embryonic stem cells. Nature. 336:684-7. doi: 10.1038/336684a0.
[9] Stewart CL, Kaspar P, Brunet LJ, Bhatt H, Gadi I, Köntgen F, Abbondanzo SJ. (1992). Blastocyst implantation depends on maternal expression of leukaemia inhibitory factor. Nature. 359:76-9. doi: 10.1038/359076a0.
[10] Maeda M, Horiuchi M, Numa S, Ichikawa Y. (1977). Characterization of a differentiation-stimulating factor for mouse myeloid leukemia cells. Gan. 68:435-47.
[11] Yamamori T, Fukada K, Aebersold R, Korsching S, Fann MJ, Patterson PH. (1998). The cholinergic neuronal differentiation factor from heart cells is identical to leukemia inhibitory factor. Science. 246(4936):1412-6. doi: 10.1126/science.2512641.
[12] Bradley A, Evans M, Kaufman MH, Robertson E. (1984). Formation of germ-line chimaeras from embryo-derived teratocarcinoma cell lines. Nature. 309:255-256. doi: 10.1038/309255a0.
[13] Mansour SL, Thomas KR, Capecchi MR. (1988). Disruption of the proto-oncogene int-2 in mouse embryo-derived stem cells: a general strategy for targeting mutations to non-selectable genes. Nature. 336:348-52. doi: 10.1038/336348a0.
[14] Sawai S, Shimono A, Hanaoka K, Kondoh H. (1991). Embryonic lethality resulting from disruption of both N-myc alleles in mouse zygotes. New Biol. 3:861-9.
[15] Saga Y, Yagi T, Ikawa Y, Sakakura T, Aizawa S. (1992). Mice develop normally without tenascin. Genes Dev. 6:1821-31. doi: 10.1101/gad.6.10.1821.
[16] Thompson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, Jones JM. (1998). Embryonic stem cell lines derived from human blastocysts. Science. 282:1145-7. doi: 10.1126/science.282.5391.1145.
[17] Brons IG, Smithers LE, Trotter MW, Rugg-Gunn P, Sun B, Chuva de Sousa Lopes SM, Howlett SK, Clarkson A, Ahrlund-Richter L, Pedersen RA, Vallier L. (2007). Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature. 448:191-195. doi: 10.1038/nature05950.
[18] Tesar PJ, Chenoweth JG, Brook FA, Davies TJ, Evans EP, Mack DL, Gardner RL, McKay RD. (2007). New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature. 448:196-199. doi: 10.1038/nature05972.
[19] Matsuda K, Mikami T, Oki S, Iida H, Andrabi M, Boss JM, Yamaguchi K, Shigenobu S, Kondoh H. (2017). ChIP-seq analysis of genomic binding regions of five major transcription factors highlights a central role for ZIC2 in the mouse epiblast stem cell gene regulatory network. Development. 144:1948-1958. doi: 10.1242/dev.143479.
[20] Chang KH, Li M. (2013). Clonal isolation of an intermediate pluripotent stem cell state. Stem Cells. 31:918-927. doi: 10.1002/stem.1330.
[21] Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S. (2007). Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131:861-72. doi: 10.1016/j.cell.2007.11.019.
[22] Iwafuchi-Doi M, Matsuda K, Murakami K, Niwa H, Tesar PJ, Aruga J, Matsuo I, Kondoh H. (2012). Transcriptional regulatory networks in epiblast cells and during anterior neural plate development as modeled in epiblast stem cells. Development. 139:3926-3937. doi: 10.1242/dev.085936.
[23] Inamori S, Fujii M, Satake S, Iida H, Teramoto M, Sumi T, Meno C, Ishii Y, Kondoh H. (2020). Modeling early stages of endoderm development in epiblast stem cell aggregates with supply of extracellular matrices. Dev Growth Differ. 62:243-259. doi: 10.1111/dgd.12663.
[24] Ying QL, Wray J, Nichols J, Batlle-Morera L, Doble B, Woodgett J, Cohen P, Smith A. (2008). The ground state of embryonic stem cell self-renewal. Nature. 453:519-23. doi: 10.1038/nature06968.
[25] Shimizu T, Ueda J, Ho JC, Iwasaki K, Poellinger L, Harada I, Sawada Y. (2012). Dual inhibition of Src and GSK3 maintains mouse embryonic stem cells, whose differentiation is mechanically regulated by Src signaling. Stem Cells. 30:1394-1404. doi: 10.1002/stem.1119.
[26] Gafni O, Weinberger L, Mansour AA, Manor YS, Chomsky E, Ben-Yosef D, Kalma Y, Viukov S, Maza I, Zviran A, Rais Y, Shipony Z, Mukamel Z, Krupalnik V, Zerbib M, Geula S, Caspi I, Schneir D, Shwartz T, Gilad S, Amann-Zalcenstein D, Benjamin S, Amit I, Tanay A, Massarwa R, Novershtern N, Hanna JH. (2013). Derivation of novel human ground state naive pluripotent stem cells. Nature. 504:282-6. doi: 10.1038/nature12745.
[27] Theunissen TW, Powell BE, Wang H, Mitalipova M, Faddah DA, Reddy J, Fan ZP, Maetzel D, Ganz K, Shi L, Lungjangwa T, Imsoonthornruksa S, Stelzer Y, Rangarajan S, D'Alessio A, Zhang J, Gao Q, Dawlaty MM, Young RA, Gray NS, Jaenisch R. (2014). Systematic identification of culture conditions for induction and maintenance of naive human pluripotency. Cell Stem Cell. 15:471-487. doi: 10.1016/j.stem.2014.07.002.
サムネイルは図7より
バックナンバー
VOL.4 胚のいつ、どこで、何を発生させるのかには欠かせない抑制機構
VOL.8 動物の形の多様性という名の変奏曲集I 目と顔と手
![[科学のコンサートホール]BRH JT生命誌研究館](/common/img/logo.svg)